Alergia, un problema actual
Las enfermedades alérgicas representan una carga creciente para la salud pública a nivel mundial. Su diagnóstico preciso continúa siendo un desafío clínico, especialmente en casos con sintomatología solapada o en reacciones graves como la anafilaxia. En este contexto, la proteómica ha emergido como una herramienta revolucionaria, al permitir el descubrimiento de nuevos biomarcadores, la comprensión profunda de los mecanismos moleculares implicados y la mejora de las estrategias diagnósticas orientadas a la medicina personalizada.
¿Cómo se produce la respuesta alérgica?
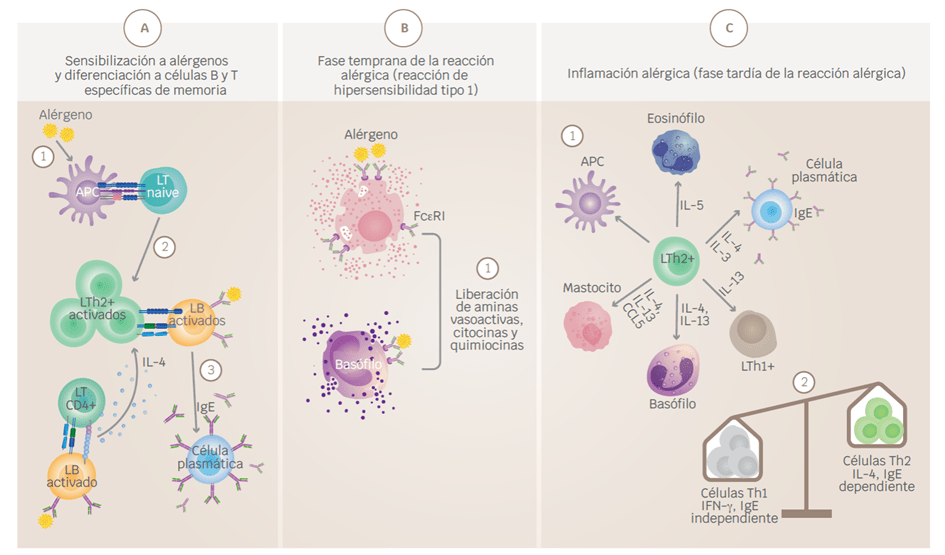
Figura 1. Inicio y desarrollo de las respuestas alérgicas. A) Sensibilización a alérgenos y desarrollo de células B y T específicas memoria. (1) La respuesta tiene inicio posterior a la exposición a un alérgeno, el cual será reconocido por las APC y presentado a las células T naive. (2) Esta interacción dará lugar a la diferenciación y expansión clonal de células T helper 2 (Th2). (3) Las células B que reconocen el alérgeno son activadas e interactúan con las células Th2, esta interacción favorece la diferenciación de las células B a células plasmáticas productoras de anticuerpos IgE. (4) La cooperación entre LTh y células B activadas favorece, además, el aumento en la expresión de citocinas como IL-4 y la diferenciación a células Th2. B) Fase temprana de la reacción alérgica (reacción de hipersensibilidad de tipo 1). (1) La IgE en conjunto con los antígenos forma complejos inmunes que se unen a los receptores de IgE de alta afinidad (FcεR1) en los basófilos y mastocitos, provocando la degranulación y liberación de mediadores proinflamatorios. C) Inflamación alérgica (fase tardía de la reacción alérgica). (1) Las exposiciones posteriores a alérgenos provocan el reclutamiento y activación de células inflamatorias y la liberación de mediadores inflamatorios. La presentación de antígenos local facilitada por IgE por las APC aumenta la activación de las células T. Los basófilos y mastocitos favorecen la exacerbación del proceso al expresar histamina, heparina y serotonina. Las células Th1 contribuyen también al proceso inflamatorio. Activación de mastocitos y basófilos, que liberan histamina, quimiocinas y otras citocinas, también contribuyen a la fase tardía de la reacción alérgica. (2) La transición de un estado de inflamación agudo a inflamación crónica está dominada por la activación de células proinflamatorias como LTh1. APC = célula presentadora de antígeno, IFNγ = interferón-γ, IL = interleucina, MHC = complejo mayor de histocompatibilidad, TNF = factor de necrosis tumoral. Créditos Sánchez-Zuno, G. A. et al., 2021 [8].
El papel de la proteómica en alergología
El hecho de que las proteínas desempeñan un papel central en los procesos alérgicos, incluidas las citocinas, alérgenos y receptores de inmunoglobulinas; permiten a la proteómica ofrecer una representación funcional directa del proceso alergénico. Este enfoque permite:
- Un diagnóstico de mayor precisión al identificar las proteínas específicas asociadas a distintos fenotipos alérgicos, mejorando la estratificación de los pacientes.
- Descubrir nuevos alérgenos, lo cual es especialmente útil en alimentos complejos o fuentes ambientales emergentes.
- Revelar biomarcadores clínicos y terapéuticos, ya que caracteriza proteínas útiles para predecir la eficacia de la inmunoterapia, la severidad de la enfermedad y el riesgo de recurrencia.
Principales metodologías proteómicas aplicadas en alergología
- Electroforesis bidimensional (2D-PAGE)
La electroforesis bidimensional constituye una de las técnicas clásicas y más robustas en proteómica. Permite comparar perfiles proteicos entre pacientes y controles sanos, separando proteínas de un extracto biológico en función del punto isoelétrico y peso molecular. Estos perfiles proteicos generados, también se han empleado en la detección de patrones diferenciales asociados a procesos inflamatorios y permitiendo identificar nuevos alérgenos asociados a alimentos o pólenes, por ejemplo. Además, es muy útil para el estudio de modificaciones postraduccionales relevantes, como la glicación en proteínas de origen alimentario, que puede incrementar su estabilidad frente a la digestión y, por tanto, potenciar su capacidad alergénica.
- Cromatografía líquida de alta resolución (HPLC)
Esta técnica permite separar y purificar proteínas alergénicas de manera eficaz, incluso en matrices biológicas y alimentarias de alta complejidad. Su aplicación en alergología es clave para aislar proteínas alergénicas específicas, facilitando su caracterización estructural. Esto es crucial para llevar a cabo estudios de unión a IgE y ensayos de inmunoterapia.
Asimismo, también se emplea en el análisis cuantitativo de alérgenos en alimentos, esencial para garantizar la seguridad alimentaria y establecer umbrales de exposición seguros en individuos sensibilizados. Por ejemplo, la cromatografía líquida de alta resolución ha permitido identificar proteínas de alta alergenicidad en productos de soja, trigo y cacahuete, incluso tras someterse a tratamientos térmicos o industriales.
- Espectrometría de masas (MS)
Es fundamental para la identificación de nuevos alérgenos a nivel molecular (como albúminas, oleosinas, etc.). Además, posibilita el mapeo de epítopos IgE, clave para diseñar inmunoterapias más seguras y personalizadas, basadas en evitar péptidos o proteínas hipoalergénicas, y manteniendo aquellas capaces de inducir tolerancia. Otra aplicación destacada es la cuantificación de proteínas en plasma o suero, asociadas a enfermedades respiratorias como la rinitis alérgica, que pueden servir como biomarcadores pronósticos y de respuesta a tratamientos.
En definitiva, la espectrometría de masas ha permitido avanzar desde la mera identificación de alérgenos hasta la comprensión de su papel inmunológico y clínico.
- Proteómica dirigida y cuantitativa (DIA, PRM, MRM)
Las metodologías de proteómica cuantitativa, como Data Independent Acquisition (DIA/SWATH), Parallel Reaction Monitoring (PRM) o Multiple Reaction Monitoring (MRM), son herramientas de alta sensibilidad y especificidad que permiten cuantificar con gran precisión proteínas de interés previamente conocidas.
En alergología, estas técnicas se aplican para la detección precisa de alérgenos en alimentos procesados, incluso en concentraciones traza, donde la desnaturalización por calor o tratamientos industriales pueden provocar modificaciones estructurales en las proteínas. Esto aumenta la fiabilidad en el etiquetado de productos alimenticios y la protección de pacientes con alergias graves.
También son esenciales en la validación de biomarcadores séricos previamente identificados en estudios de descubrimiento, lo que permite el desarrollo de paneles diagnósticos personalizados.
Finalmente, también permiten el seguimiento longitudinal de pacientes bajo inmunoterapia específica, evaluando la eficacia de los tratamientos mediante la monitorización de proteínas clave asociadas con tolerancia o persistencia de la respuesta alérgica.
Estas metodologías podrían ser el impulso hacia una alergología de precisión, donde el tratamiento se adapta al perfil molecular del paciente.
Algunos ejemplos de proteínas en procesos alergénicos
- Citocinas Th2 clave: IL‑4, IL‑5 e IL‑13
Estas interleucinas, producidas por linfocitos Th2, eosinófilos, basófilos y células dendríticas, son determinantes en las respuestas alérgicas. Algunas como la IL‑4 e IL‑13, promueven la producción de IgE por los linfocitos B y activan vías inflamatorias en epitelio respiratorio. Otras, como la IL‑5 es fundamental para la diferenciación, activación y reclutamiento de eosinófilos, mediadores centrales en las fases tardías de la inflamación alérgica.
- Alérgenos alimentarios
Algunas proteínas alergénicas comunes en alimentos reconocidas clínicamente son:
- 2S álbuminas, 7S/11S globulinas y nsLTPs en frutos secos, semillas, legumbres y frutas.
- Caseínas, β-lactoglobulina, α-lactalbumina en leche de vaca; ovomucoide, ovalbúmina en huevo; y β-parvalbúmina en pescados como los principales alérgenos IgE mediadas.
- Tropomiosinas en crustáceos, moluscos y parásitos de pescado, con alta capacidad de reactividad cruzada.
Conclusión
El desarrollo y la implementación de tecnologías proteómicas han permitido un abordaje más preciso, personalizado y predictivo en el diagnóstico y tratamiento de las enfermedades alérgicas. Gracias a su capacidad para identificar biomarcadores funcionales y caracterizar respuestas inmunológicas a nivel molecular, la proteómica contribuye significativamente a la prevención de alergias alimentarias.
La integración de la proteómica con otras disciplinas ómicas (como la genómica y la metabolómica), así como con herramientas de inteligencia artificial, augura una nueva era en la alergología de precisión, donde el tratamiento podrá adaptarse al perfil molecular individual de cada paciente, optimizando así la eficacia clínica y minimizando riesgos.
AUTORA
Inmaculada Fdez-Cañadas Schez-Aguilera
Técnico titulado superior
Hospital Nacional de Parapléjicos.
Toledo, España.
Referencias
[1] Nguyen, N. T., Järvinen, K. M., Galli, S. J., & Bajic, A. (2024). Plasma proteomic profiling reveals biomarkers associated with anaphylaxis. Frontiers in Immunology, 15, 1328212.
[2] Zhao, Y., Chen, Z., Li, M., & Wang, S. (2024). Detection and quantification of peanut allergens in complex processed foods using LC–MS techniques. Journal of Agricultural and Food Chemistry.
[3] Picariello, G., Mamone, G., Nitride, C., & Ferranti, P. (2023). Targeted proteomics as a tool to detect allergenic proteins in food matrices. Foods, 12(4), 789.
[4] Venter, C., Brown, K., Maslin, K., & O’Mahony, L. (2023). The role of the gut microbiome and microbial-derived metabolites in food allergy and tolerance. International Journal of Molecular Sciences, 24(3), 2234.
[5] Matricardi, P. M., Kleine-Tebbe, J., Hoffmann, H. J., Valenta, R., Hilger, C., Hofmaier, S., … Ollert, M. (2021). Molecular allergology and component-resolved diagnosis in allergy. Clinical Chemistry and Laboratory Medicine, 59(5), 857–868.
[6] García-Casado, G., Crespo, J. F., Barber, D., Rodríguez, J., & Salcedo, G. (2020). Two-dimensional electrophoresis immunoblotting in the diagnosis of food allergy. Food Chemistry.
[7] Sánchez-Zuno, G. A., Oregón-Romero, E., Hernández-Bello, J., González-Estevez, G., Vargas-Rosales, R., & Muñoz-Valle, J. F. (2021). Enfermedades reumáticas y alergias, la dualidad del sistema inmunológico. Revista alergia México, 68(4), 264-275.
Para más información, dudas o solicitud de presupuestos puedes contactarnos en: unidadproteomica.hnp@sescam.jccm.es
Si quieres conocer más sobre nosotros: https://saishnp.com/
Síguenos en:
http://www.linkedin.com/in/servicios-de-apoyo-a-la-investigación-sais-hnp