Hemos hablado en newsletters anteriores sobre la necesidad cada vez mayor de distinguir, identificar y caracterizar un mayor número de poblaciones y subpoblaciones celulares presentes en una muestra heterogénea compleja, incluso a nivel de célula única, para conocer su funcionalidad y su posible papel en distintas patologías. Asimismo, cobra gran importancia la posibilidad de separar físicamente cada uno de esos subtipos celulares con el fin de estudiarlos en profundidad posteriormente, como por ejemplo mediante diferentes técnicas -ómicas.
La caracterización e identificación de todos estos subtipos celulares en la muestra viene dada por la utilización de múltiples marcadores que caracterizan de forma específica dichas poblaciones. A mayor nº de marcadores/colores utilizados, mayor nº de poblaciones y subpoblaciones se pueden identificar.
La citometría se basa en el uso de anticuerpos o sondas marcadas con fluorocromos, que como todos sabemos, son compuestos químicos con capacidad de absorber luz a diferentes longitudes de onda según un espectro de excitación, y de liberar fotones de luz a longitudes de onda mayores según un espectro de emisión. Los espectros de excitación y emisión son únicos para cada fluoróforo (Fig. 1).

Fig. 1Espectro de excitación y emisión de la phycoeritrin (PE)
En un citómetro convencional, los detectores del equipo mediante el uso de filtros de banda, sólo recogen una parte del espectro de emisión del fluoróforo en cuestión (color azul en Fig.1), que suele coincidir con la zona del espectro de mayor emisión. La citometría espectral, en cambio, se basa en recoger todo el espectro de emisión de un fluoróforo mediante el uso de arrays de detectores que cubren desde longitudes de onda cercanas (350 nm, aprox.) hasta lejanas (900 nm aprox.).
Vamos a ver un poco más en profundidad en qué consiste la citometría espectral y cómo se utiliza en un citómetro separador que además tiene la posibilidad de darnos la imagen de las células (BD-FACS Discovery S8 cellsorter).
TECNOLOGÍA ESPECTRAL
La citometría de flujo convencional utiliza espejos y filtros para seleccionar rangos longitudes de onda específicos (Fig.1), mientras que la citometría de flujo espectral utiliza una matriz de detectores que recoge la luz emitida en un rango entre 350 y 900 nm, lo que permite medir los espectros completos de cada partícula (Fig.2).
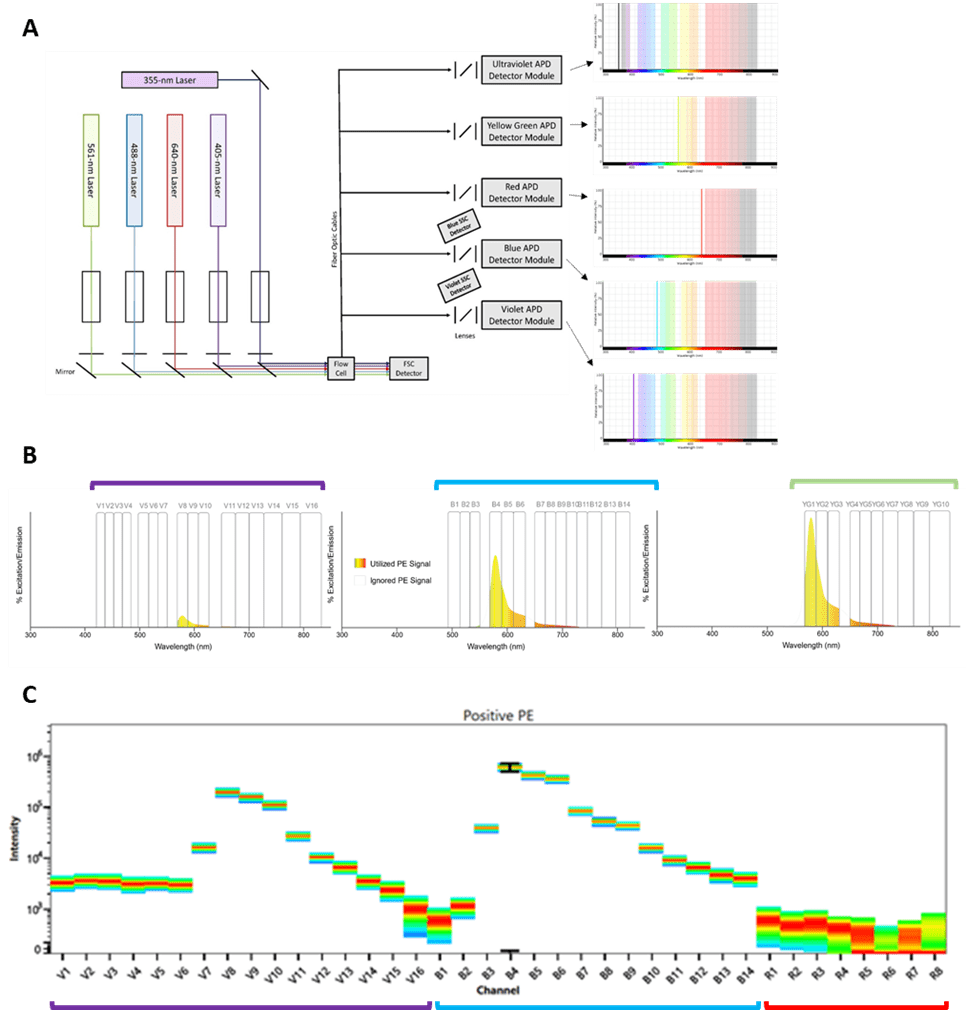
Fig. 2. Tecnología espectral. A, esquema del sistema de detectores de un citómetro espectral (Cytek) Espectro de excitación y emisión de la phycoeritrin (PE). B, detección del espectro de emisión de PE por los arrays de detectores. C, firma espectral de la PE
Gracias al sistema de arrays de detectores (Fig.2A), se recoge la señal emitida por cada fluoróforo excitado a diferentes longitudes de onda que emite cada láser(Fig.2B), obteniéndose así una firma espectral única para cada fluoróforo (Fig.2C).
Puesto que se pueden distinguir las firmas espectrales de cada fluoróforo, esto va a permitir que se puedan combinar un nº elevado de colores en un mismo panel de anticuerpos o reactivos, incluso con espectros de excitación y emisión muy parecidos (ej. APC y Alexa Fluor 647), ya que van a tener una firma espectral diferente en la mayor parte de los casos.
Cuando una muestra se adquiere en estos citómetros, para cada una de las células presentes en la muestra se obtiene un espectro de fluorescencia compuesto por los espectros de todos y cada uno de los fluoróforos para los que sean positivas. A continuación, el software del equipo realiza (a tiempo real) una deconvolución espectral, que consiste en comparar los espectros medidos (todas las fluorescencias combinadas) de una célula determinada, con las firmas espectrales de cada fluoróforo por separado y, mediante el uso de un algoritmo,calcula el porcentaje del espectro de cada célula correspondiente a cada fluoróforo por separado (Fig.3). Una vez conocida la intensidad de fluorescencia de cada marcador, la representación gráfica de los datos es igual que en citometría convencional.

Fig. 3.Ejemplo de deconvolución espectral. El software determina la proporción de cada espectro de referencia que se adapta mejor a la muestra completamente teñida
de las ventajas de la citometría espectral es que permite substraer la autofluorescencia, ya que podemos obtener la firma espectral de la autofluorescencia de las células sin teñir y, mediante la deconvolución, substraerla de la señal de cada célula teñida. Esto nos va a permitir tener una mayor limpieza de los datos y detectar fluorescencias de baja intensidad que pueden quedar ocultas por la autofluorescencia de las células.
Con esta tecnología ya existen paneles publicados de hasta 40 colores para una sola muestra.
COMBINACIÓN CITOMETRÍA ESPECTRAL, SEPARACIÓN CELULAR E IMAGEN
Lo mejor de lo mejor es poder combinar múltiples parámetros de forma simultánea, que nos permitan una mejor identificación de poblaciones que queramos separar para ulteriores análisis, como por ejemplo, mediante técnicas –ómicas o de célula única. Si a esto le unimos la posibilidad de tener una imagen de cada una de las células, obtener colocalización de marcadores, etc. tenemos una potente tecnología en nuestras manos.
Con esta idea, BD Biosciences ha lanzado recientemente al mercado el BD FACS Discovery S8 CellSorter con tecnología Cell View.

Este citómetro combina la citometría espectral con la separación celular. Permite separar hasta 6 poblaciones diferentes de forma simultánea, permitiendo la separación en placas multipocillo incluso a nivel de célula única, identificar las células que se han separado en cada pocillo en los gráficos de citometría, e incluso tener una imagen de cada célula con hasta 3 imágenes de fluorescencia.
La tecnología CellView permite, no sólo la visualización de las células, sino también realizar diversos análisis a partir de las imágenes: tamaños, intensidades de fluorescencia, interacciones célula-célula (sinapsis celular), grado de co-localización de fluorescencias, análisis de fagocitosis, etc. Y con todo esto “separar lo que ves, y ver lo que separas”.

CONCLUSIÓN
La citometría espectral es una tecnología que nos permite caracterizar mucho mejor una muestra al utilizar de manera eficiente muchos más fluoróforos (reactivos, anticuerpos), y unida a la separación celular en un citómetro espectral separador, nos permite identificar y purificar poblaciones muy específicas e incluso raras para su posterior estudio profundo.
Virginia Vila del Sol.
Responsable del Servicio de Citometría de Flujo
Hospital Nacional de Parapléjicos.
Toledo, España.
DECLARACIÓN DE NO CONFLICTO DE INTERESES
La autora declara no haber recibido beneficio alguno de BD Biosciences, así como que la presente newletter no tiene fines publicitarios.
Para más información, dudas o solicitud de presupuestos puedes contactarnos en:citometria.hnp@sescam.jccm.es
Si quieres conocer más sobre nosotros: https://hnparaplejicos.sanidad.castillalamancha.es/es/profesionales/investigacion/servicios-apoyo/citometria
Síguenos en:
www.linkedin.com/in/servicios-de-apoyo-a-la-investigación-sais-hnp