El procesamiento de una muestra da lugar a una población de células muertas y debris celular, independientemente del protocolo empleado. La eliminación de dichas células del posterior análisis es un paso crítico en citometría de flujo, ya que pueden unir anticuerpo de manera inespecífica, dar autofluorescencia o incluso formar agregados al ser más pegajosas. A diferencia de la necrosis o muerte celular accidental, la apoptosis, o muerte celular programada, es un proceso muy controlado y complejo que se produce de forma natural en las células. A continuación veremos ejemplos de tintes con los que medir viabilidad celular así como ensayos de medida de apoptosis a través de alteraciones en la membrana plasmática o fragmentación de ADN mediante citometría de flujo.
ETIDIO Y CALCEÍNA
Mediante la tinción simultánea con Calceína AM y Etidio podemos discriminar rápidamente las células vivas de las muertas.
La Calceína AM posee una cola AM (acetoximetilo) unida por medio de un éster a la calceína, la cual le permite el paso por la membrana plasmática. Una vez dentro, las esterasas intracelulares rompen dicha cola reteniendo el colorante y haciendo que las célula vivas se tiñan de verde fluorescente (Calceína+Etidio-). El Etidio, se une al ADN y da un color rojo fluorescente para indicar la pérdida de integridad de la membrana plasmática en las células muertas (Calceína-Etidio+).
En el caso de las células moribundas, los poros en sus membranas hacen que la Calceína quede libre pudiendo salir de las células y dar lugar a una intensidad de fluorescencia menor. Además, el Etidio también será capaz de llegar al núcleo y unirse al ADN (Calceína+Etidio+).
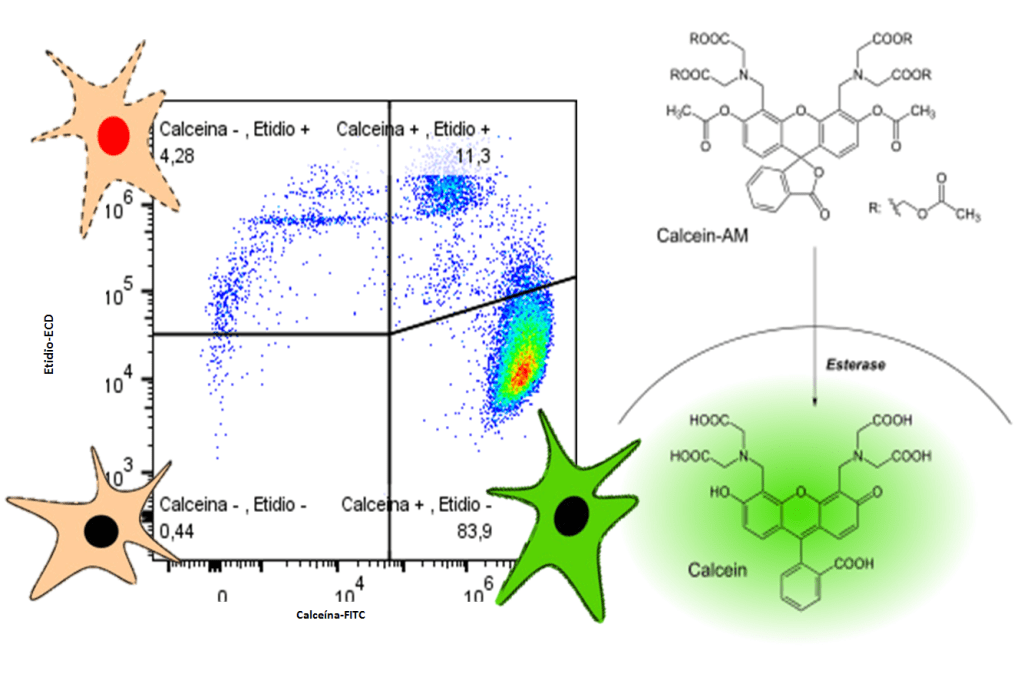
Figura 1.Datos pertenecientes al grupo Fisiopatología Vascular (FPVI).
ANEXINA V Y 7AAD
Uno de los ensayos de apoptosis más importantes es la medida de alteraciones de membrana mediante ANEXINA V.
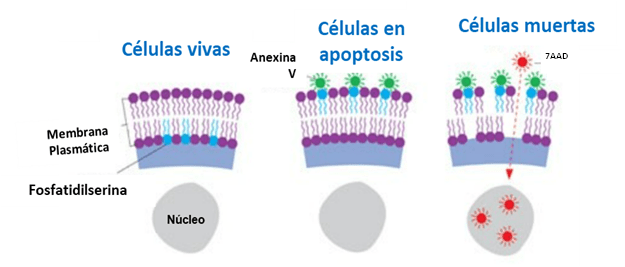
En las células vivas, los residuos de fosfatidilserina se encuentran en la cara interna de la membrana plasmática. Cuando la célula entra en apoptosis, se produce un cambio en la membrana que consiste en la externalización de dichos residuos.
La Anexina V es una proteína recombinante que se une específicamente a los residuos de fosfatidilserina cuando estos están expuestos en la cara externa de la membrana plasmática, siendo un biomarcador efectivo en células apoptóticas. La Anexina V puede ser combinada con un marcador de ADN como el 7-AAD o el yoduro de propidio (PI), con el fin de distinguir células apoptóticas de necróticas. Estos tintes no pueden atravesar la membrana celular. Sin embargo, en el caso de células muertas o moribundas, en las que la membrana plasmática presentan poros, estos tintes pueden penetrar fácilmente e intercalarse en el ADN celular generando una señal fluorescente específica. De manera que, las células que solo son AV+7AAD-, son células con apoptosis temprana; mientras que, las AV+7AAD+, serían células que sufren apoptosis tardía o muerte.

TUNEL (Terminal dUTP Nick End-Labeling)
Uno de los ensayos ampliamente empleados para la determinación y cuantificación de la apoptosis “in situ” es el denominado TUNEL. Este ensayo permite la determinación de los fragmentos de ADN cortados por la acción de endonucleasas activadas por caspasas, familia de proteínas clave en la ejecución de la muerte celular programada.
Los extremos 3’-OH del ADN dañado se marcan fluorescentemente mediante la adición de dUTP nucleótidos catalizada por la enzima terminal deoxynucleotidyl transferase (TdT), y se visualizan en el citómetro de flujo. Se trata de un método rápido que permite la determinación y cuantificación de células apoptóticas.
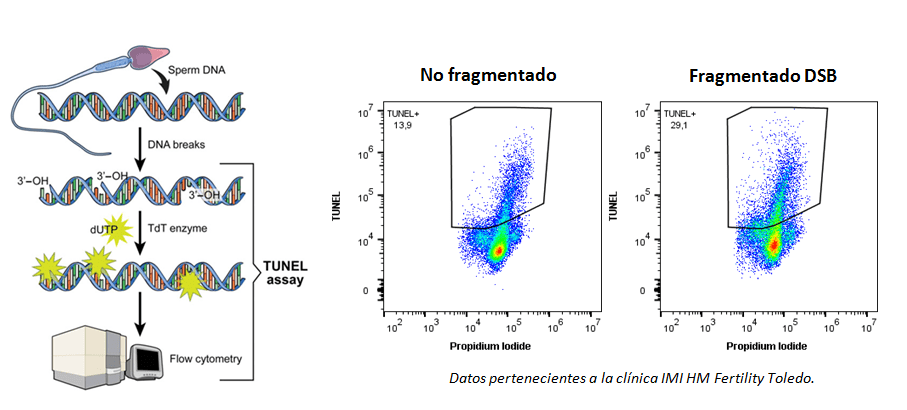
TINTES DE VIABILIDAD FIJABLES
Muchos de los reactivos utilizados para medir viabilidad celular, no son compatibles con la fijación, ya que durante este proceso se produce una permeabilización suficiente como para dejar pasar estos reactivos al interior celular, tanto en células muertas como en células vivas.
Actualmente se están desarrollando muchos reactivos que permiten la detección de células muertas en muestras fijadas, ya que cada vez existen más protocolos en los que se necesita permeabilizar y fijar las muestras (ej.: tinción intracelular).
Estos reactivos, a diferencia de los tintes de unión al ADN descritos anteriormente, se unen a grupos amino reaccionando con todas las proteínas celulares y, dado que son impermeables a las membranas celulares intactas, solo pueden unirse a las proteínas de la superficie de las células vivas. En el caso de las células muertas, la fluorescencia será mayor puesto que en el interior celular podrá unirse a un mayor número de proteínas.
Dado que estas moléculas pueden soportar las duras reacciones de entrecruzamiento asociadas con la fijación, se pueden usar dentro de los protocolos de fijación y permeabilización.
TIPS finales
- ¿Tu muestra está fijada o no?
- Utiliza siempre tinte de viabilidad para mayor limpieza y sensibilidad del ensayo.
- Elige un tinte de viabilidad compatible con tu panel.
- Utiliza controles positivos (ej.: PFA) y negativos.
- Titula las sondas de viabilidad: en exceso pueden resultar citotóxicas.
AUTORA
Ángela Marquina Rodríguez
Técnico Titulado Superior del Servicio de Citometría.
Hospital Nacional de Parapléjicos.
Toledo, España.
Para más información, dudas o solicitud de presupuestos puedes contactarnos en: citometria.hnp@sescam.jccm.es
Si quieres conocer más sobre nosotros: Citometría HNP
Síguenos en:
www.linkedin.com/in/servicios-de-apoyo-a-la-investigación-sais-hnp