Los organismos biológicos, órganos, tejidos y células tienen un amplio rango dinámico de abundancia de proteínas. Aunque es importante saber qué proteínas se expresan en un determinado sistema como consecuencia de su genoma, estas proteínas están presentes en diferentes cantidades, y solo un número limitado se ve afectado durante un evento fisiológico. Esto puede incluir una etapa de desarrollo, diferenciación, episodio o trastorno degenerativo, entre otros. Por lo tanto, los estudios proteómicos ya no están interesados solo en qué proteínas están presentes en un momento dado, sino también qué proteínas y en qué cantidad tienen sus niveles de expresión afectados como consecuencia de un estímulo, lesión, enfermedad u otro evento.
Para abordar las preguntas de qué proteínas están implicadas, por cuánto y lo que es más importante, qué isoformas lo están, se pueden emplear técnicas de fraccionamiento de proteínas para aumentar el poder de resolución y discriminar aún más entre diferentes isoformas de proteínas, como son el 2D-PAGE, la cromatografía de exclusión por tamaño [SEC], la cromatografía líquida de fase reversa [RPLC], las columnas de intercambio catiónico [SCX] y el isoelectroenfoque [IEF]. Sin embargo, las técnicas de fraccionamiento de proteínas son desafiantes y el análisis de proteína intacta top-down en cromatografía líquida sigue siendo difícil.
Es importante destacar que las técnicas de separación de proteínas no deben modificar la muestra y el método debe ser sólido. El análisis de un proteoma de mamífero en tales condiciones produce una mezcla compleja de péptidos que supera ampliamente las capacidades de una separación por cromatografía 1D. La introducción de técnicas de resolución de péptidos multidimensionales tiene un valor incuestionable para la caracterización de proteomas complejos, con la identificación de miles de péptidos en experimentos de shotgun.
Cromatografía de intercambio de iones (IEC)
2D-LC-MS/MS se introdujo por primera vez utilizando la cromatografía de intercambio catiónico (SCX) en la primera dimensión, un tipo de IEC que implica la separación de péptidos según las diferencias en su carga eléctrica. El mecanismo de retención de analitos en estos enfoques implica la atracción electrostática entre los analitos y los grupos funcionales de la fase estacionaria, que tienen cargas opuestas. En la SCX, los grupos funcionales negativos atraen péptidos cargados positivamente a pH ácido, mientras que en la cromatografía de intercambio aniónico (SAX), los grupos funcionales positivos tienen afinidad por los péptidos cargados negativamente a pH básico. El principal inconveniente del uso de un soporte de sílice es la limitación del pH impuesta por la inestabilidad de la sílice a pH alto y bajo (es decir, por encima de pH 8 y por debajo de pH 2). De las diversas formas de IEC, SCX con un gradiente de sal o saltos de sal es la técnica de fraccionamiento más utilizada para la proteómica. En los enfoques SCX, los péptidos se resuelven en función de su carga total eluyendo primero el péptido con la carga neta menos positiva. Al aumentar la concentración de sal en un experimento SCX, el tiempo de retención disminuye debido a la disminución de las interacciones electrostáticas y al aumento de la fuerza iónica. Aunque se ha demostrado que SCX es una excelente combinación con fase reversa (RP) para separaciones proteómicas multidimensionales, la resolución limitada eventualmente restringirá la utilidad de esta técnica para mezclas complejas.
Cromatografía de fase reversa
La cromatografía de fase reversa es el modo cromatográfico más utilizado que permite la separación de moléculas neutras en solución en función de su hidrofobicidad. La separación se basa en el coeficiente de reparto de analitos entre la fase móvil polar y la fase estacionaria hidrófoba (no polar). En el caso de los péptidos, los péptidos más polares eluyen primero, mientras que los péptidos menos polares interactúan más fuertemente con los grupos hidrofóbicos que forman una capa «similar a un líquido» alrededor del soporte sólido de sílice.
La RPLC se ha aplicado ampliamente en la separación de péptidos por su facilidad de uso con gradientes de elución, compatibilidad con muestras acuosas y versatilidad del mecanismo de retención, lo que permite cambios en la separación provocados por cambios en el pH, modificadores orgánicos o aditivos. Varios factores influyen en la capacidad de los picos cromatográficos, como la temperatura, la longitud de la columna, la fase estacionaria, el tamaño de las partículas, el reactivo de emparejamiento iónico de la fase móvil, el modificador de la fase móvil y la pendiente del gradiente. La cromatografía de fase reversa es muy versátil y fácil de usar, y ha sido probada para la separación de péptidos en primera dimensión.
Cromatografía líquida de interacción hidrofílica
La cromatografía líquida de interacción hidrofílica (HILIC) es algo similar a la cromatografía de fase normal y se usa más comúnmente para separar analitos polares y péptidos hidrofílicos. Esta separación se caracteriza por el uso de una fase estacionaria hidrofílica, es decir, grupos ciano, diol, amino y otros modificando la resina cromatográfica, y una fase móvil orgánica hidrofóbica. El paso de elución ocurre aumentando la polaridad de la fase móvil, normalmente realizando un gradiente de agua que da como resultado un orden de elución invertido en relación con RPLC, es decir, los péptidos menos polares eluyen primero y los péptidos más polares eluyen después. También se ha descubierto que HILIC permite el enriquecimiento y el análisis dirigido de modificaciones postraduccionales, como glicosilación, N-acetilación y fosforilación, en aplicaciones proteómicas.
Cromatografía líquida 2D
Se requieren herramientas analíticas multidimensionales que tengan modos de separación ortogonales para superar el problema de resolución insuficiente en el análisis de matrices biológicas complejas y para reducir la complejidad de la muestra (Figura 1). En un sistema de separación 2D, se prefieren las separaciones ortogonales porque los diferentes mecanismos de retención de las dos columnas permiten la resolución de los componentes que coeluyen en la separación de la primera dimensión. Por lo tanto, SCX se ha utilizado ampliamente en combinación con RP. El uso de un pH alto en la separación de péptidos de primera dimensión también demostró ser útil para IEC. Sin embargo, debido a los residuos ácidos, la separación de péptidos trípticos por SAX demostró ser más exitosa que el enfoque SCX, donde se observó un aumento en el número de péptidos identificados. Sin embargo, durante la separación por intercambio de aniones, las sales indeseables siempre presentes en la fase móvil continúan siendo una desventaja para este enfoque. En la cromatografía RP-RP, los péptidos que eluyen temprano en la primera dimensión eluyen temprano en la segunda dimensión, al igual que los péptidos que eluyen más tarde. Aunque las separaciones a pH alto y bajo no son completamente ortogonales, se observa un alto grado de complementariedad, lo que convierte a esta combinación en un enfoque interesante tanto para la separación 2D off line como en línea de péptidos de mezclas complejas.
Un enfoque de separación 2D exitoso no se limita a la separación de péptido a péptido, sino que también se puede lograr mediante la separación de proteína a péptido. Se han aplicado varios métodos para la primera dimensión, incluida la electroforesis en gel y la RPLC. Un extracto de proteína de Escherichia coli se resolvió con éxito mediante RPLC o electroforesis en gel, y las fracciones posteriores se digirieron y analizaron mediante LC-MS/MS.
Los enfoques en línea dan como resultado menos manejo de muestras, menos pérdida de muestras y, en algunos casos, consumen menos tiempo. Por otro lado, requieren configuraciones integrales con más bombas, válvulas, trampas y fases móviles compatibles con MS (o extensos pasos de lavado entre la primera y la segunda dimensión). Los enfoques off-line son más simples de implementar, menos estrictos en la compatibilidad de la fase móvil, permiten la modificación química entre la primera y la segunda dimensión y también son más flexibles.
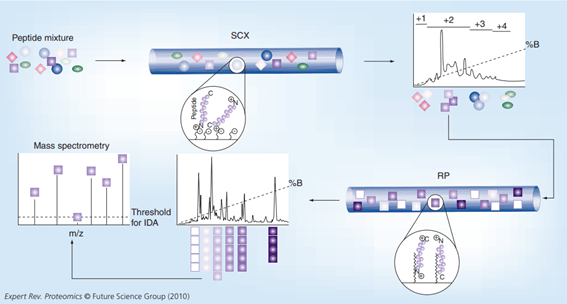
Figura 1. Flujo de trabajo de cromatografía líquida-espectrometría de masas 2D. Una mezcla compleja de péptidos se resuelve primero usando SCX (intercambio catiónico fuerte), donde los péptidos cargados positivamente interactúan con grupos de fase estacionaria cargados negativamente. Los péptidos se resuelven según su carga usando un gradiente de sal. Luego, cada fracción SCX se resuelve mediante cromatografía líquida RP (fase reversa), donde los péptidos interactúan con la fase estacionaria C18 y se resuelven según su hidrofobicidad con un gradiente orgánico. A continuación, los péptidos eluidos se analizan mediante espectrometría de masas en tándem en el modo IDA (adquisición dependiente de datos), en el que se seleccionan los iones más intensos del espectro de masas para una mayor fragmentación.
Enfoque isoeléctrico
El enfoque isoeléctrico (IEF) es una técnica de electroforesis de alta resolución para la separación y concentración de moléculas anfóteras según su punto isoeléctrico (pI). La IEF se lleva a cabo en una solución sin tampón, que contiene anfolitos portadores o un gel de gradiente de pH inmovilizado (IPG). El sistema permite que la separación de proteínas y péptidos tenga lugar en un sistema de dos fases con una fase líquida superior que se divide en compartimentos y una fase inferior que es una tira de IPG rehidratada convencional. Normalmente, la muestra se diluye en el tampón de enfoque y se carga en todos los pocillos. Debido a que no existe una conexión fluídica entre los pocillos, los péptidos se ven obligados a migrar a través del gel de IPG donde tiene lugar la separación real. Los péptidos al estar presentes en la fase líquida se pueden recuperar convenientemente de los pocillos para su posterior análisis mediante RPLC-MS/MS. El valor de pI proporcionado se puede utilizar como una herramienta de filtrado y validación independiente durante las búsquedas en bases de datos para la identificación de secuencias peptídicas de MS/MS. Algunas de las ventajas de usar tiras de IPG incluyen, entre otras, alta resolución, alta carga de muestras, control total de un rango de pH bien definido, capacidad de buffering o reguladora, fuerza iónica y la flexibilidad de elegir el gradiente de pH deseado. Una desventaja es el largo tiempo de ejecución del fraccionamiento en este tipo de sistemas (que varía de unas pocas horas a 2 o 3 días según la composición de la muestra) en comparación con otras técnicas off line, como SCX o RP.
Conclusión
Cada enfoque mencionado en esta newsletter se puede aplicar con éxito, pero el resultado depende en gran medida de la composición de la muestra que se analiza. De hecho, parece que la separación de péptidos en la segunda dimensión está más estandarizada debido a los requisitos de una buena ionización de péptidos para el análisis de MS. La separación de la primera dimensión se puede realizar a nivel de proteínas o de péptidos, donde las separaciones de proteínas basadas en gel son los enfoques más rentables y simples. Sin embargo, es importante tener en cuenta la pérdida de proteínas, ya que los enfoques cromatográficos para resolverlas pueden provocar una gran precipitación e insolubilidad de proteínas. Hasta la fecha, no existe un único enfoque de separación de péptidos que permita la identificación de todos los péptidos de una mezcla compleja. Si se desea una cobertura amplia del proteoma, se deben tener en cuenta múltiples enfoques.
AUTOR
Alba González Arandilla, MSc.
Especialista en espectrometría de masas.
Hospital Nacional de Parapléjicos.
Toledo, España.
Referencias
Peptide fractionation in proteomics approaches
Comparison of peptide and protein fractionation methods in proteomics