Una de las creencias más arraigadas en el mundo de la neurociencia es que la citometría de flujo es una técnica que sólo sirve para analizar células “de la sangre”. Nada más lejos de la realidad: cualquier célula es susceptible de ser analizada por citometría, pero es cierto que existen algunos requerimientos que pueden limitar la aplicación de la técnica, como es la necesidad de tener una suspensión de células individualizadas o la existencia de reactivos que permitan detectar las células de interés.
Y ese es el verdadero motivo por el que hacer citometría del sistema nervioso supone un reto que a veces culmina con el abandono de la técnica, muchas veces por el esfuerzo que supone poner a punto un experimento sobre todo a nivel de tiempo empleado, ya que existe la presión de obtener resultados de forma rápida e inmediata para poder mantener el ritmo de publicaciones exigido. Probablemente hemos olvidado que “la paciencia es la madre de la ciencia”.
En esta Newsletter pretendemos dar algunas claves para animaros a probar la citometría como técnica de análisis en Neurociencia.
- PROBLEMAS
Existen tres problemas principales que limitan la aplicación de la citometría de flujo en el análisis del sistema nervioso:
- Elevada integración de las células neurales en el parénquima, lo que hace que los protocolos de disgregación de los tejidos deban poner especial cuidado en obtener una suspensión celular sin que las células sufran demasiado daño, y en que se mantenga la integridad de los antígenos que nos van a permitir identificarlas.
- Alto contenido en lípidos del tejido, siendo la mielina responsable de gran parte del debris celular que se detecta cuando analizamos células del sistema nervioso por citometría. A mayor incremento de mielina en la suspensión celular, más problemas de detección de la tinción van a ocurrir.
- Carencia de marcadores específicos de subtipos de células nerviosas, ya que, al tener un origen común, muchos de los marcadores son compartidos entre subtipos. Además, a veces es difícil encontrar anticuerpos específicos contra los antígenos concretos, que estén conjugados directamente con fluorocromos para citometría de flujo.
Estos problemas van a tener como consecuencia que, en algunos casos, no se puedan realizar todas las aplicaciones posibles de la citometría.
- CÉLULA A CÉLULA
Al igual que los diferentes tipos celulares del sistema nervioso tienen diferentes funciones, no todos los problemas a los que nos enfrentamos les afectan a todos por igual.
Astrocitos
Una de las aplicaciones de la citometría más utilizadas en el estudio de los astrocitos es la separación celular activada por fluorescencia o FACS (“Fluorescence-Activated Cell Sorting”), a partir tanto de tejido neonatal como adulto. Dependiendo de la aplicación posterior que se quiera dar a los astrocitos separados (cultivo, congelación, análisis ómicos, etc), hay que tener en cuenta algunas consideraciones.
Si se quieren separar por FACS, hay que tener en cuenta que los astrocitos expresan marcadores en su superficie que no son totalmente específicos y se pueden encontrar tanto en NSCs como en oligodendrocitos (OLs) y/o neuronas. En ratón, el antígeno ACSA-2 se ha descrito como específico de astrocitos (se co-expresa con GLAST), mientras que en rata y humano el antígeno más utilizado para su detección es GLAST-1 (Fig.1).

Figura 1. Experimento de separación celular de astrocitos de corteza cerebral de rata neonatal. A) Estrategia de análisis pre-sort. Se aisló por FACS la población Glast-1+ B) Análisis post-sort. Resultados del Grupo de Reparación Neural
El marcador intracelular GFAP requiere la permeabilización celular para su detección, con lo que es incompatible con el cultivo posterior de los astrocitos aislados. Sin embargo, sí puede utilizarse en experimentos de fenotipado por citometría.
Neuronas
De todos los tipos celulares, las neuronas son las más sensibles a los métodos de aislamiento. La separación celular por citometría para obtener poblaciones enriquecidas en neuronas sería la técnica ideal, pero el primer problema lo encontramos con la limitada disponibilidad de marcadores y anticuerpos específicos de neuronas. Entre estos marcadores tenemos CD24, que es un marcador de superficie y se ha utilizado para separar neuronas. Sin embargo, la naturaleza del proceso FACS, que implica el sometimiento de la muestra a una elevada presión y a fuerzas electrostáticas, hace que se produzca una marcada disminución de la integridad celular y de la viabilidad de las neuronas. Por tanto, la obtención de neuronas viables para mantener posteriormente en cultivo por FACS, es prácticamente inviable.
Sin embargo, se han desarrollado protocolos que permiten la separación de núcleos de neuronas (u otros tipos celulares) mediante “Fluorescence Activated Nuclei Sorting” – FANS para el análisis posterior de perfiles genéticos, epigenéticos, de factores de transcripción y de expresión génica. Se utiliza un protocolo específico para la obtención de núcleos, junto con una tinción específica de neuronas como puede ser NeuN, y se purifican los núcleos NeuN+ para su posterior secuenciación (Nott, A. et al, 2021). La tinción con NeuN, que requiere permeabilización, puede utilizarse también en experimentos de fenotipado por citometría.
Oligodendrocitos
Después de las neuronas, los OLs son los tipos celulares que sufren más en los protocolos de disociación y FACS. Además, hay que tener en cuenta que el rendimiento celular es menor que para otros tipos celulares porque cuando se realizan gradientes (de sacarosa, Percoll u Optiprep) para eliminar la mielina de la muestra, muchos de los OLs se quedan atrapados en la fase de mielina.
En contrapartida, existen varios marcadores de superficie específicos de los distintos estadios de diferenciación, como pueden ser A2B5 (Fig.2) u O4, que permiten su separación por FACS y su caracterización por citometría (Robinson, AP et al 2014).

Figura 2. Análisis de precursores de OLs de corteza de rata. En este experimento se utilizó A2B5 como marcador de precursores de OLs. Resultados del Grupo de Neuroinflamación
Microglía
Debido a su origen hematopoyético, distinto de los otros tipos celulares que encontramos en el sistema nervioso, la microglía carece de la mayor parte de los problemas mencionados anteriormente. Se aísla fácilmente a través de disociación mecánica y gradiente de percoll, y existen varios marcadores que pueden ayudar a definirla, como son CD11b y CD45 (Fig.3)
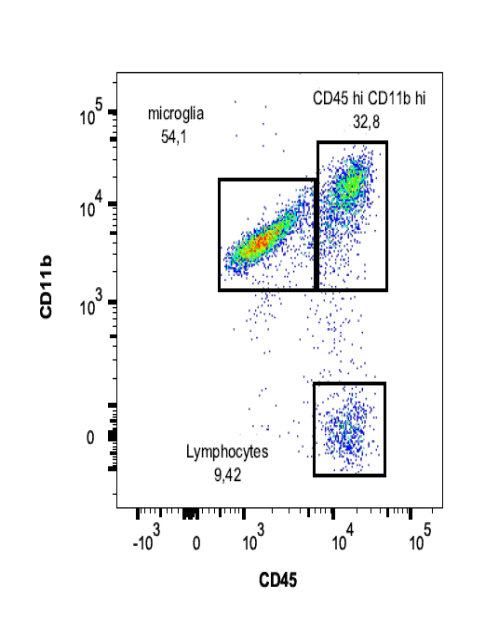
Fig.3. Análisis de infiltrados y microglía en cerebro de ratón con daño traumático. El fenotipo de la microglía por citometría de flujo puedo definirse en función de los niveles intermedios de expresión de CD45 y CD11b, en comparación con los niveles de expresión elevados de estos marcadores presentes en las células infiltradas como causa de un daño traumático. Resultados del Grupo de Neurofisiología Experimental en colaboración con el Grupo de Neuroinmunoreparación (Rosa, JM et al 2021)
Fig.3. Análisis de infiltrados y microglía en cerebro de ratón con daño traumático. El fenotipo de la microglía por citometría de flujo puedo definirse en función de los niveles intermedios de expresión de CD45 y CD11b, en comparación con los niveles de expresión elevados de estos marcadores presentes en las células infiltradas como causa de un daño traumático. Resultados del Grupo de Neurofisiología Experimental en colaboración con el Grupo de Neuroinmunoreparación (Rosa, JM et al 2021)
- ALGUNAS IDEAS PARA MEJORAR LOS PROBLEMAS
A los tres problemas principales que limitan la aplicación de la citometría de flujo en el análisis del sistema nervioso, proponemos pequeñas soluciones/ideas:
- Disgregación del tejido. Después de la disgregación mecánica es importante elegir una adecuada disgregación enzimática, teniendo en cuenta que puede afectarse la integridad de los antígenos que queremos identificar. Así, algunos antígenos soportarán mejor la digestión unas enzimas que con otras. Podéis revisar la tabla 1 para ayudaros a elegir.
- Alto contenido en lípidos del tejido. El modo de eliminar la mielina del homogenado puede favorecer la obtención de unos tipos celulares respecto a otros. La utilización de gradientes (de sacarosa, percoll, Optiprep) ha sido siempre el protocolo más utilizado, pero actualmente existen otras alternativas, como la de Miltenyi, que tiene un sistema con esferas magnéticas para eliminar la mielina de la suspensión celular (Myelin Removal Beads 130-096-731).
- Carencia de marcadores específicos de subtipos de células nerviosas. Es cierto que aún existe cierta dificultad para encontrar antígenos específicos de los distintos tipos celulares y que los que hay, no siempre nos permiten usarlos para realizar FACS. Como una pequeña ayuda podéis consultar la tabla 2 que contiene los marcadores utilizados habitualmente.

Tabla 1. Miltenyi Biotec
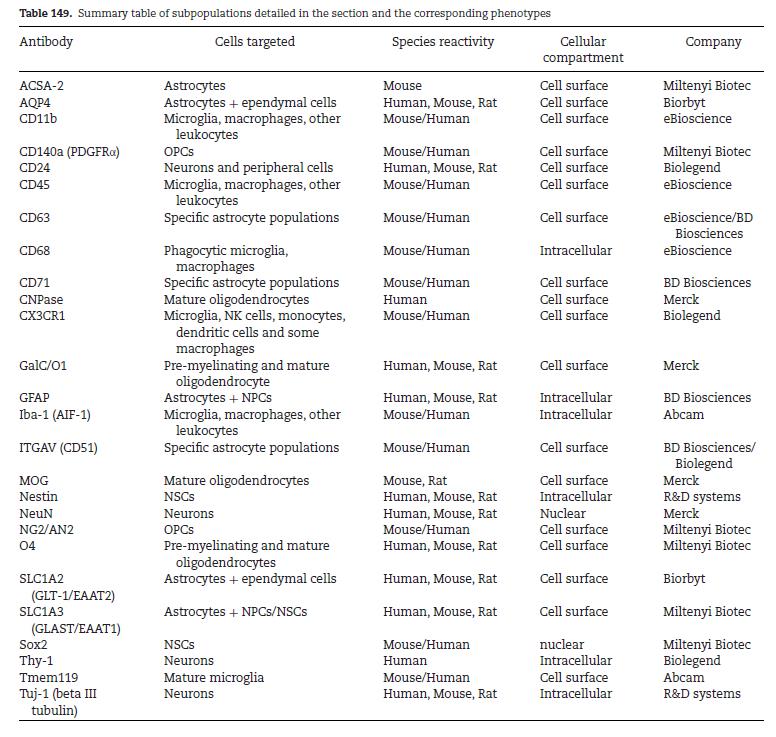
Tabla 2. Cossarizza A et al 2021
CONCLUSION
La citometría de flujo supone una potente herramienta en el estudio del sistema nervioso a pesar de las limitaciones expuestas en esta Newletter. Desde el CITF-SAI estamos dispuestas a ayudaros a establecer el mejor protocolo para ello, y por eso queremos ofreceros un descuento del 50 % en vuestro próximo experimento con Citometría de Flujo. Para ello, sólo tenéis que enviarnos un correo a citometría.hnp@sescam.jccm.es, solicitando dicho descuento. ¡Os esperamos!
AUTOR
Virginia Vila del Sol, PhD.
Responsable del Servicio de Citometría de Flujo
Hospital Nacional de Parapléjicos
Toledo, España.
Bibliografía
- Cossarizza A, et al. (2021) Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol, 51(12), 2708-3145. https://doi.org/10.1002/eji.202170126
- Nott A, et al. (2021) Nuclei isolation of multiple brain cell types for omics interrogation. Nat Protoc., 16(3),1629-1646. 10.1038/s41596-020-00472-3
- Rosa JM, et al. (2021) TLR4 pathway impairs synaptic number and cerebrovascular functions through astrocyte activation following traumatic brain injury. Br J Pharmacol. Sep;178(17):3395-3413. https://doi.org/10.1111/bph.15488
- Robinson AP, et al (2014). Characterization of oligodendroglial populations in mouse demyelinating disease using flow cytometry: clues for MS pathogenesis. PLoS One. 23;9(9): e107649. https://doi.org/10.1371/journal.pone.0107649