En anteriores entregas de newsletter de citometría os hablamos de las vesículas extracelulares (VEs) y de la información mínima que debe contener un estudio de VEs según establece la guía MiFlowCyt-EV. La Sociedad Internacional de Vesículas Extracelulares (ISEV) pretende asegurar con dicha guía una correcta identificación de VEs (NL20-CITF02 Vesículas Extracelulares 1 junio 2020).
Por tanto, en esta nueva entrega veremos cómo puede contribuir la citometría en el estudio de VEs procedentes de diferentes células o fluidos biológicos. Concretamente, veremos 2 ejemplos en los que se emplean VEs para terapia en lesión medular o spinal cord injury (SCI) y VEs como fuente de biomarcadores en Esclerosis Múltiple (EM).
- VEs PROCEDENTES DE CÉLULAS MADRE NEURALES COMO TRATAMIENTO EN SCI1
El trasplante de células madre neurales o Neural Stem Cell (NSC) es una estrategia prometedora tras una SCI ya que dichas células tienen la capacidad de autorrenovarse y producir neuronas, oligodendrocitos y astrocitos que promuevan la recuperación funcional. Sin embargo, el trasplante directo de NSC a los tejidos diana sigue siendo un desafío debido a la baja tasa de supervivencia de las células trasplantadas, así como los riesgos de desdiferenciación celular, rechazo inmunológico y formación de tumores.
En este artículo se estudian los efectos terapéuticos de las VEs procedentes de NSC (NSC-sEVs), como alternativa al trasplante directo de NSCs en SCI. Puesto que, tras una SCI surgen una serie de daños secundarios retardados debidos a la inflamación, entre los que destaca la apoptosis celular, estos autores utilizaron el tratamiento con glutamato (Glu; 100uM) en un cultivo primario de neuronas como modelo in vitro de muerte celular inducida por SCI, y miden el efecto del pretratamiento con NSC-EVs sobre la apoptosis inducida por Glu. Mediante citometría de flujo se observó que la exposición a Glu aumentaba significativamente la apoptosis neuronal en comparación con los controles sin dicho tratamiento. Por el contrario, al tratar el modelo in vitro de SCI con vesículas procedentes de células madre neurales (NSC-sEVs), vieron que la apoptosis se reducía considerablemente y que el tratamiento con inhibidores de la autofagia revertían parcialmente los efectos de las VEs, indicando que estas estaban ejerciendo sus efectos incrementando la autofagia celular.
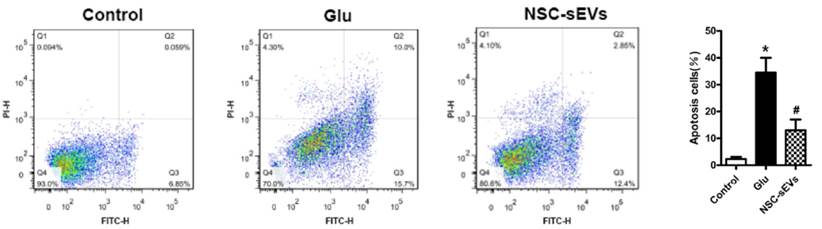
Figura 1. Cultivo primario de neuronas teñido con Anexina V-FITC y PI para la detección de apoptosis inducida con glutamato con o sin tratamiento de NSC-EVs mediante citometría de flujo y cuantificación de los resultados. Los dot plot muestran como varía el porcentaje de células apoptóticas (Q2) entre las muestras tratadas con Glu (10,0%) frente a las pre-tratadas con VEs procedentes de células NSC (2,85%).
Por tanto, el tratamiento con NSC-sEVs presenta efectos neuroprotectores contra la excitotoxicidad ocasionada por el glutamato, además de efectos anti-inflamatorios, por lo que se postula como una prometedora y novedosa terapia para el futuro de los pacientes con lesión medular.
- VEs COMO BIOMARCADORES EN LÍQUIDO CEFALORRAQUÍDEO (LCR) Y LÁGRIMA EN EM 2
Las vesículas están surgiendo como nuevos biomarcadores asociados a diversas enfermedades neurológicas como la Esclerosis Múltiple (EM). Además, se están buscando nuevas fuentes poco invasivas como las lágrimas que representan una interesante fuente de vesículas extracelulares debido a su relación con el sistema nervioso central (SNC).
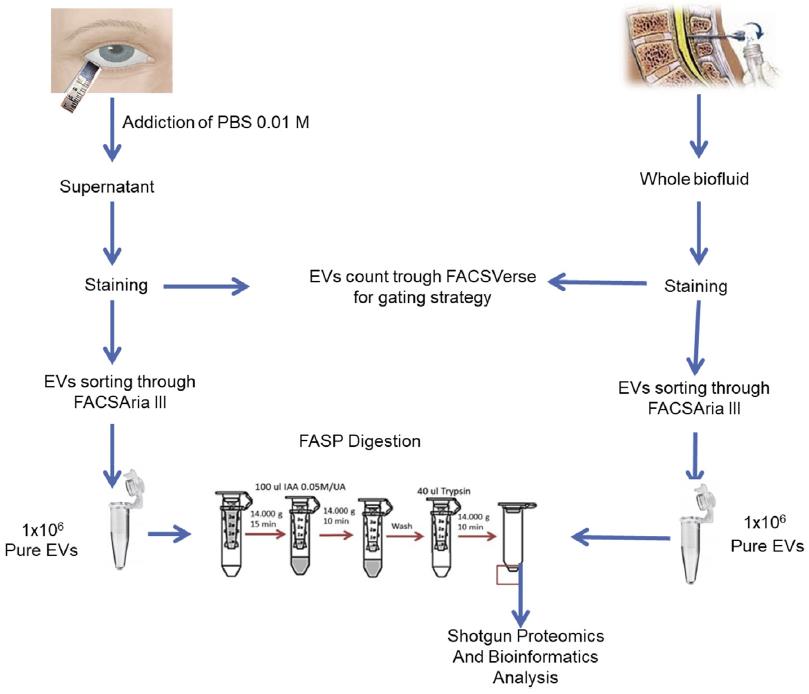
Figura 2. Esquema de flujo de trabajo de la estrategia experimental utilizada para analizar y purificar VEs procedentes de líquido cefalorraquídeo y lágrima. Se recogen muestras de 7 pacientes sanos y 7 enfermos con EM, tanto de lágrima como LCR para realizar un pool.
En este artículo caracterizan y separan VEs de LCR y lágrimas (Fig. 2) mediante citómetría de flujo, y determinan por primera vez, la presencia de VEs derivadas de microglia y SNC en lágrimas de pacientes con EM y sujetos sanos. Para la detección de EVs en ambos fluidos biológicos, se utiliza un colorante catiónico lipofílico o lipophilic cationic dye (LCD) que emite en rojo (APC) y permite atravesar la doble capa lipidica de las vesículas y marcarlas. Para determinar la procedencia de dichas EV, las muestras se marcaron con marcadores específicos para microglía (CD45-APC Cy7 y CD11b-V500)ypara células neurales (CD171-V450 y CD56-PE).
Los gráficos de contorno resaltan la presencia de VE microgliales (CD11b+ CD45-) y neuronales (CD45- CD56- CD171+) tanto en muestras procedentes de lágrimas como de LCR, sugiriendo una conexión entre ambos fluidos biológicos que se confirmará mediante proteómica.

Figura 3. Análisis de las EVs procedentes de CFS y lágrimas. La estrategia de análisis consiste en una región “EVs” con los eventos positivos para LCD (dot plot FSC-H vs LCD-H) que se identificó como “EVs”. La región EV se representó en un gráfico CD11b V500-H vs CD45 APC-Cy7-H, donde se realizo la región “CD11b+” que corresponderá a VEs derivado de microglia. Por último, se representa en un grafico CD56 PE-H vs CD171 V450-H, la región «NOT-CD45» (EVs CD45 negativos), identificándose en dicha población las VEs derivadas de neuronas con la región “CD171+” (eventos CD171+).
Para la realización del análisis proteómico, las EVs se purificaron empleando citometría de flujo. Para ello, las EVs se marcaron con LCD (LCD-APC) y faloidina (faloidina-FITC), que se une a la actina del citoesqueleto en vesículas que tienen la membrana dañada. Por tanto, los eventos positivos para LCD y negativo para faloidina fueron los que se aislaron (región “EVs”), con una pureza mayor del 92% (gráfico derecha).
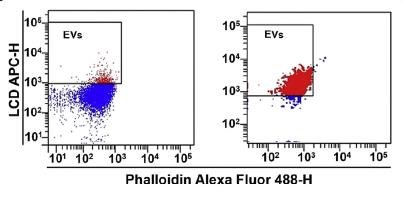
Figura 4. Análisis tras la separación de la pureza de la muestra de EVs y eficiencia de la separación. El gráfico de la izquierda muestra la región “EVs” que se ha separado (faloidina- LCD +); mientras que el de la derecha es la muestra post-sort que contiene las EVs CD45+ que se han separado mediante citometría.
El análisis proteómico de estas vesículas obtenidas del LCR y de las lágrimas mostró resultados similares entre ambos fluidos. Esto demuestra que existe una intercomunicación molecular específica mediada por vesículas entre el LCR y las lágrimas, lo cual abre la puerta a nuevas perspectivas diagnósticas para la EM.
CONCLUSIÓN
La citometría de flujo supone una potente herramienta en el estudio de las VEs ya que permite caracterizar una a una las vesículas presentes en una muestra, cuantificarlas, purificarlas, así como determinar su posible potencial terapéutico.
AUTOR
Ángela Marquina Rodríguez, MSc.
Bioquímica
Técnico Titulado Superior del Servicio de Citometría de Flujo
Hospital Nacional de Parapléjicos
Toledo, España.
Bibliografía
- Rong, Y., Liu, W., Wang, J., Fan, J., Luo, Y., Li, L., Kong, F., Chen, J., Tang, P., & Cai, W. (2019). Neural stem cell-derived small extracellular vesicles attenuate apoptosis and neuroinflammation after traumatic spinal cord injury by activating autophagy. Cell death & disease, 10(5), 340. https://doi.org/10.1038/s41419-019-1571-8
- Pieragostino, D., Lanuti, P., Cicalini, I., Cufaro, M. C., Ciccocioppo, F., Ronci, M., Simeone, P., Onofrj, M., van der Pol, E., Fontana, A., Marchisio, M., & Del Boccio, P. (2019). Proteomics characterization of extracellular vesicles sorted by flow cytometry reveals a disease-specific molecular cross-talk from cerebrospinal fluid and tears in multiple sclerosis. Journal of proteomics, 204, 103403. https://doi.org/10.1016/j.jprot.2019.103403
Un comentario en “CITOMETRIA DE FLUJO Y VEs EN LESIÓN MEDULAR Y ENFERMEDADES NEURODEGENERATIVAS”