En la última newsletter de citometría mostramos cómo es posible medir la movilización de Ca2+, así como las concentraciones de magnesio (Mg) y zinc (Zn) mediante citometría de flujo.
En esta segunda entrega de citometría de flujo para monitorizar procesos intracelulares, veremos cómo medir especies reactivas de oxígeno (ROS) y el potencial de membrana mediante citometría de flujo.
- ESPECIES REACTIVAS DE OXÍGENO o ROS
Las especies reactivas de oxígeno o ROS son moléculas muy pequeñas y altamente reactivas debido a la presencia de una capa de electrones de valencia no apareada (figura 1). Estas especies se forman de manera natural como subproducto del metabolismo normal del oxígeno, actuando como mensajero secundario de las células al igual que el calcio.
Dependiendo de la concentración, las ROS pueden ser beneficiosas o perjudiciales para las células ya que participan en procesos de señalización celular, homeostasis y apoptosis.
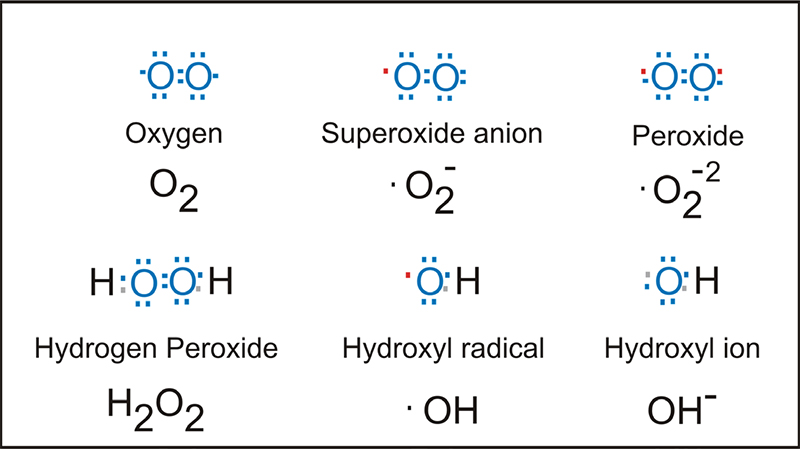
Figura 1. Especies reactivas de oxígeno o ROS.
Algunas de las formas en las que ROS puede causar daño en las células son:
- Daño en ADN o ARN.
- Oxidación de ácidos grasos poliinsaturados en lípidos.
- Oxidación de aminoácidos en proteínas.
- Desactivación oxidativa de enzimas especificas mediante la oxidación de co-factores.
- Las células cancerígenas tienen mayores niveles de ROS que las células normales.
- ROS puede jugar un papel determinante en el declive de la memoria con la edad.
Existen una gran variedad de sondas que se pueden emplear para medir diferentes especies ROS que se han recogido en la tabla 1.
| Fluorocromo | Ex máx. | Em máx. | Diana detectada |
| Dihidroetidio o hidroetidina (HE) | 518 nm | 606 nm | Anión superóxido |
| Dihidrorodamina (DHR123) | 507 nm | 529 nm | ROS Anión superóxido |
| DCFH-DA | 495 nm | 529 nm | H202 (NO directamente) |
| CellROX Green Orange Deep Red | 485 nm 545 nm 640 nm | 520 nm 565 nm 665 nm | ROS Nuclear Citoplasmático Citoplasmático |
Tabla 1. Sondas para la detección de especies reactivas de oxigeno (ROS).
El seguimiento de los niveles de ROS en lesión medular es fundamental tanto para estudiar el mecanismo del daño secundario como para evaluar la eficacia de los antioxidantes. La citometría de flujo ha surgido como un método rápido y eficaz para detectar específicamente ROS en el interior celular, ya que, a diferencia de otros métodos disponibles, los niveles de ROS intracelulares pueden evaluarse célula a célula eliminando las interferencias del tejido.
Para utilizar este tipo de ensayo en tejido nervioso es recomendable añadir un paso de fijación con paraformaldehído entre la disociación del tejido a células individuales en suspensión y la tinción de la muestra. De esta forma, se eliminan los posibles errores que pueden ocurrir al eliminar células que generalmente tienen un nivel más alto de ROS o producen más ROS durante el proceso de disociación.
En este ejemplo se utilizó la sonda hidroetidina (HE), que emite a 606 nm y cuya diana es el anión superóxido (O2–) (tabla 1),en un modelo animal de lesión medular. HE se oxida a etidio (ethidium) por acción del O2– producido en las células, ya que éste no puede atravesar fácilmente la membrana, siendo la intensidad de fluorescencia del interior de la célula directamente proporcional a la producción total de O2–.
Los resultados mostraron un aumento significativo de ROS en el protocolo que fija la muestra previamente a su disociación, respecto al protocolo sin fijación. Además, se encontró una disminución más pronunciada de ROS con el paso de fijación, en respuesta al tratamiento con MnTBAP, un mimético de la SOD (superóxido dismutasa) que inhibe la oxidación de HE (Figura 2C vs 2D).
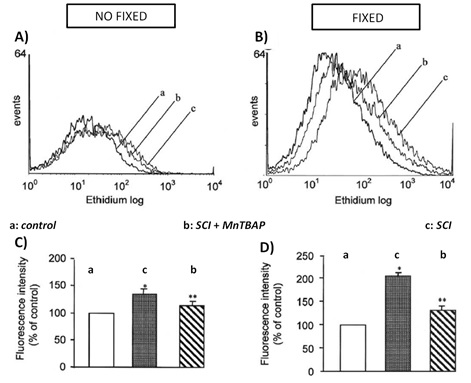
Figura 2. Comparativa de un protocolo sin fijación frente a otro en el que se fija la muestra para el análisis mediante citometría de flujo de O2– intracelular. Se compararon 3 grupos donde se observa en B) y D) una disminución en la oxidación de HE (ethidium) con el tratamiento de MnTBAP (b) respecto al control (a) y a la muestra SCI sin tratar (c). Figura modificada de Luo, J et al., 2002.
- POTENCIAL DE MEMBRANA
La pérdida del potencial de membrana mitocondrial es un marcador distintivo de apoptosis temprana. Por tanto, es posible evaluar la apoptosis determinando cambios en el potencial de membrana mitocondrial (Δψm) mediante citometría de flujo, empleando para ello colorantes fluorescentes.
Un aspecto clave a tener en cuenta para realizar este tipo de ensayo es que el proceso de preparación de la muestra, ya que puede inducir la pérdida de células apoptóticas (tripsinización prolongada, disgregación mecánica o enzimática de los tejidos, etapas de centrifugación). Si se trabaja con cultivos celulares adherentes es importante recolectar las células que se han liberado en el medio. Y en la separación de células mediante gradiente de densidad también se puede perder selectivamente células apoptóticas debido a sus diferentes densidades.
SONDAS PARA MEDIR Δψm
Los fluorocromos utilizados en el análisis del potencial de membrana son lipofílicos para poder atravesar las bicapas lipídicas. Además, tienen carga positiva mientras que la cara interna de la membrana mitocondrial presenta carga negativa. Tras la tinción con la sonda pueden ocurrir dos cosas:
- Despolarización, es decir, un descenso de la diferencia de potencial de la membrana mitocondrial por el cual el fluorocromo es enviado hacia el medio celular.
- Hiperpolarización o aumento de la diferencia de potencial, lo que da lugar a una entrada masiva de fluorocromo hacia el interior de la mitocondria.
| Fluorocromo | Ex máx. | Em máx. |
| TMRM,TMRE | 553 nm | 576 nm |
| Mitotracker Red | 580 nm | 600 nm |
| Rodamina 123 (R123) | 507 nm | 529 nm |
| DiOC6 (3) | 488 nm | 506 nm |
| JC-1 | 500 nm | 520/590 nm |
Tabla 2. Sondas para la detección del potencial de membrana (Δψm).
JC-1 es un ejemplo de sonda mitocondrial que se excita a 500 nm y emite a 520/590 nm (ver tabla 1). A medida que se pierde el potencial mitocondrial durante el proceso de apoptosis, la emisión de JC-1 cambia de rojo a verde, lo que da lugar a una disminución de la proporción de fluorescencia rojo/verde. El principio de este fenómeno es que la sonda se acumula a altas concentraciones en mitocondrias sanas, formando agregados o multímeros (J-agregados) y emitiendo a 590 nm (rojo). Al romperse la membrana mitocondrial, la sonda se libera al citoplasma y pasa a ser un monómero al reducir la concentración de la sonda, lo que conlleva el cambio de su espectro máximo de emisión a 520 nm (verde) (ver figura 3).
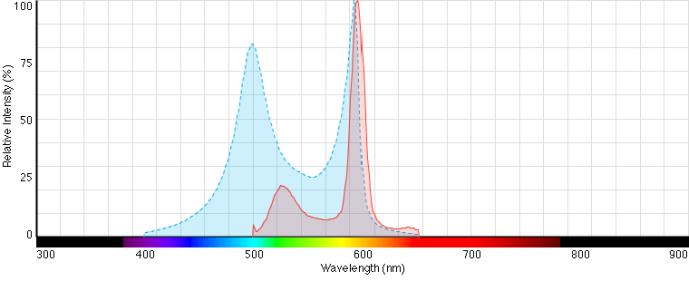
Figura 3. Espectros de excitación (azul) y emisión (rojo) del fluorocromo JC-1. Si JC-1 se encuentra formando agregados su emisión será a 590 nm, es decir, rojo; mientras que, cuando se encuentra en estadío monomérico, emite a 514nm, en verde.
CONCLUSIÓN
La medida de ROS y el potencial de membrana, junto con los iones intracelulares Ca2+, Mg y Zn mediante citometría de flujo nos demuestra el poder de la citometría de flujo en la monitorización de procesos intracelulares. Permitiéndonos evaluar célula a célula cambios en las concentraciones de iones intracelulares.
Las posibilidades que oferta esta gran herramienta a los investigadores son infinitas, con el fluorocromo adecuado todo es posible.
AUTOR
Ángela Marquina Rodríguez, MSc.
Bioquímica
Técnico Titulado Superior del Servicio de Citometría de Flujo
Hospital Nacional de Parapléjicos
Toledo, España.
REFERENCIAS
- Luo, J., Li, N., Paul Robinson, J., & Shi, R. (2002). Detection of reactive oxygen species by flow cytometry after spinal cord injury. Journal of neuroscience methods, 120(1), 105–112. https://doi.org/10.1016/s0165-0270(02)00193-0.
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., & Gelbard, H. A. (2011). Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. BioTechniques, 50(2), 98–115. https://doi.org/10.2144/000113610.
- Cossarizza, A., Chang, H. D., Radbruch, A., Akdis, M., Andrä, I., Annunziato, F., Bacher, P., Barnaba, V., Battistini, L., Bauer, W. M., Baumgart, S., Becher, B., Beisker, W., Berek, C., Blanco, A., Borsellino, G., Boulais, P. E., Brinkman, R. R., Büscher, M., Busch, D. H., … Zimmermann, J. (2017). Guidelines for the use of flow cytometry and cell sorting in immunological studies. European journal of immunology, 47(10), 1584–1797. https://doi.org/10.1002/eji.201646632.