La técnica más conocida en citometría de flujo es, sin duda, el inmunofenotipaje. En él se emplean anticuerpos conjugados con fluorocromos que se unen a proteínas celulares y las marcan, permitiendo determinar los diferentes tipos de células presentes en una muestra. Sin embargo, siempre que exista un marcador fluorescente, la citometría de flujo nos va a permitir medir diferentes procesos biológicos.
El más común de estos ensayos es el de movilización de Ca2+. Además del calcio, mediante citometría de flujo es posible medir concentraciones de magnesio (Mg), zinc (Zn), especies reactivas de oxígeno (ROS) e, incluso, el potencial de membrana. En esta primera entrega de citometría de flujo para monitorizar procesos intracelulares, nos centraremos en cómo lograr mediciones precisas de Ca2+ intracelular y hablaremos de las sondas que nos permiten medir Mg y Zn.
- MOVILIZACIÓN DE CALCIO (Ca2+)
Los iones de calcio juegan un papel especialmente crítico en la señalización celular. Como mensajero secundario, está involucrado en una gran variedad de procesos celulares: neurotransmisión, contracciones musculares, expresión génica, actividad enzimática, apoptosis… Los niveles de calcio, tanto en la sangre como en las células, están estrechamente regulados para garantizar que la concentración citoplasmática se encuentre en el rango de 100nM, ya que el calcio es un potente desencadenante de procesos biológicos. Los mecanismos de la homeostasis del Ca2+ incluyen secuestrarlo en diferentes orgánulos, así como secretar activamente el exceso de Ca2+ de la célula.
Existen varios compuestos capaces de emitir fluorescencia en respuesta a Ca2+ (incremento y disminución). Algunos ejemplos se muestran en la Tabla 1.
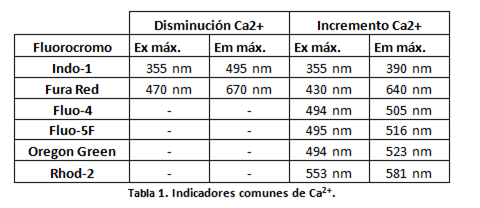
Las dos primeras sondas, Indo-1 y Fura Red, se usan típicamente para medir cambios en la concentración de calcio intracelular mediante la monitorización de la excitación o la emisión de dicha sonda ya que permiten realizar mediciones ratiométricas. Esto significa que podemos monitorizar el ratio calcio unido/no unido gracias a sus propiedades espectrales, ya que les permiten responder de manera diferente tanto al incremento del Ca2+ intracelular como a la disminución del mismo. Por ejemplo, la sonda Indo-1 que se excita con un láser UV, en ausencia de Ca2+ emite fluorescencia a 495 nm, y cuando tiene lugar un incremento en los niveles de Ca2+ intracelulares, deja de emitir a esa longitud de onda y comienza a emitir fluorescencia a 390 nm (ver figura 1). Haciendo el ratio entre las medidas de fluorescencia a ambas longitudes de onda, podemos monitorizar el incremento en los niveles de Ca2+ (ver figura 4).
En el caso de no contar con citómetro con láser UV, podemos utilizar Fura-Red como colorante ratiométrico (ver figura 2).
El empleo de estas sondas ratiométricas aumenta la precisión de la medida de las concentraciones de calcio intracelular, proporcionando resultados más sólidos y reproducibles.
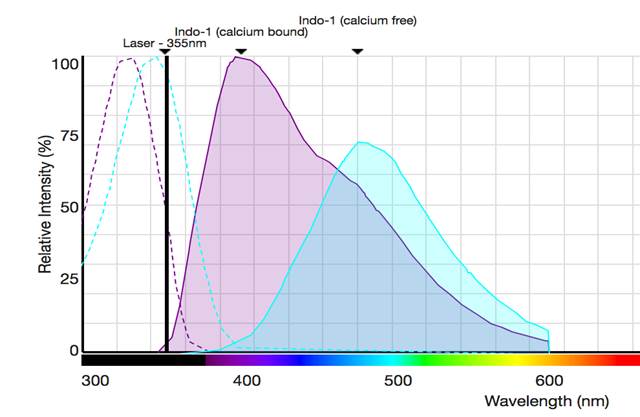
Figura 1. Espectros de excitación y emisión de Indo-1. El marcador ratiométrico más utilizado es Indo-1, que se excita mediante el láser UV emitiendo a 390 nm (violeta) y cambia su espectro de emisión cuando no se une al calcio, emitiendo a 495 nm (verde). Al evaluar la relación de Ca2+ unido/no unido, se puede medir una reacción cinética más precisa e independiente de la carga de sonda en las células.
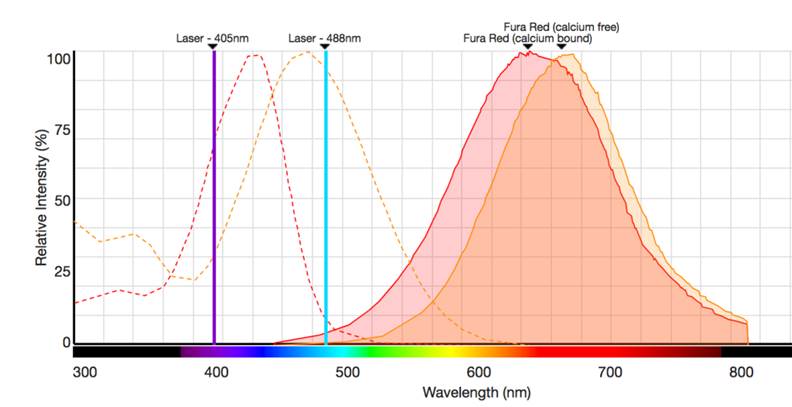
Figura 2. Espectros de excitación y emisión de Fura Red. Esta sonda emite fluorescencia a 640 y 670 nm, pero difiere en su capacidad de excitación. Cuando no está unida a Ca2+ es excitada por el láser violeta (405nm), mientras que cuando los niveles de Ca2+ aumentan, la sonda pasa a excitarse con el láser azul (488nm), produciéndose un aumento de la fluorescencia en el detector correspondiente para este láser. A su vez, disminuye la señal en el detector del láser violeta. La relación entre la fluorescencia producida por la excitación a 405 nm y la producida a 488 nm, nos permitirá monitorizar el incremento de los niveles de Ca2+.
El resto de los indicadores de la tabla, conocidos como sondas sensor, sóolo responden a un aumento de calcio aumentando su emisión de fluorescencia. Por tanto, las mediciones se realizan con un solo color. Con este tipo de sondas deben tenerse en cuenta diferentes efectos como son: la tinción desigual de las células como consecuencia de diferencias en el grosor de la membrana celular de distintos tipos celulares presentes en la muestra, el fotoblanqueo o photobleaching (destrucción fotoquímica de un fluoróforo), , así como las posibles fugas de sonda del interior celular.
CONSIDERACIONES PARA DISEÑAR EL EXPERIMENTO
En el diseño general de un experimento de monitorización de calcio, existen una serie de factores que deben tenerse en cuenta:
- Láseres disponibles. La mayoría de los indicadores de calcio se excitan con el láser de 355 nm, 405 nm o 488 nm. Por tanto, en caso de querer acoplar el ensayo de calcio al de inmunofenotipaje, con el objetivo de ver qué células están respondiendo a un estímulo dado, se debe elegir una sonda que solo responda a un incremento de Ca2+ (sonda “sensor”).
- Tipo de sonda: se recomienda utilizar una sonda ratiométrica, cuyo pico de excitación o emisión cambia en presencia de calcio.
- Mantener la temperatura a 37ºC para favorecer la cinética de la reacción.
- Capturar la respuesta inicial al Ca2+. Una limitación de estos ensayos era que no se podía captar el flujo justo al instante de agregar el agonista, ya que la adquisición en el equipo debía interrumpirse para agregarlo. Sin embargo, en el servicio de Citometría contamos con el citómetro CytoFlex S, que nos permite añadir el agonista sin detener la adquisición gracias a su bomba peristáltica, lo que permite obtener un registro completo e ininterrumpido de los datos de cada muestra (ver figura 3).
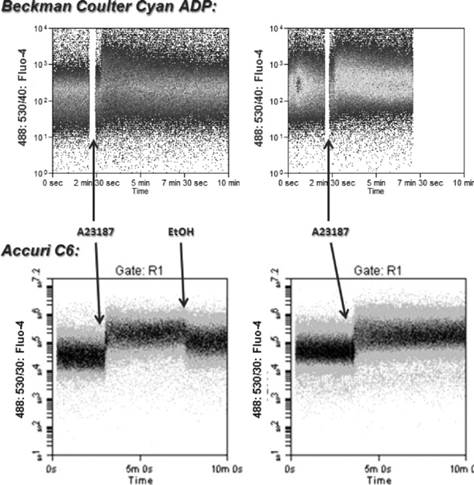
Figura 3. Comparación de las mediciones de Ca2+ usando dos tipos de citómetros. El citómetro Beckman Coulter Cyan APD requiere detener la adquisición para agregar el ionóforo A23187, de esta manera se pierden los datos de calcio de la respuesta inmediata. Sin embargo, Accuri C6 de Beckman Coulter, consta de un sistema de fluidos que trabaja mediante bombas peristáltica (al igual que el CytoFlex S) donde no es necesario interrumpir la adquisición de muestra, evitando así la pérdida de datos.
EJECUCIÓN DEL EXPERIMENTO
Las células se tiñen con la sonda seleccionada para el experimento. El flujo se controla mediante el cambio de fluorescencia de la sonda. Los tubos que contienen las muestras se adquieren en el citómetro de flujo durante unos 30-60 segundos para establecer unos valores de referencia antes de agregar el antagonista.
Una vez que la señal se ha estabilizado, se agrega un ionóforo de calcio (ionomicina o A23187) rápidamente al tubo, que transportará iones de calcio a través de la membrana plasmática causando la máxima respuesta en las células y ocasionando la liberación de Ca2+.En la Figura 4 se muestra un ejemplo de análisis de un experimento de monitorización de Ca2+.
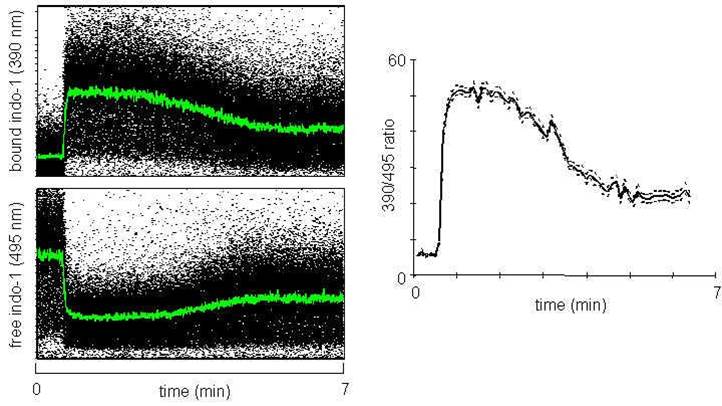
Figura 4. Ejemplo de análisis de un experimento de movilización de calcio. Se comienza con la adquisición de datos durante 30-60 segundos, tras lo que se añade iononomina 1 µM a la población celular. Las gráficas de puntos de la izquierda muestran la emisión de fluorescencia a 390 nm (indo-1 unido a Ca2+, gráfico superior) y 495 nm (indo-1 libre, gráfico inferior). Por último, en el gráfico de la derecha, se representa la relación entre la emisión a 390nm y 495nm. 1
La técnica de movilización de calcio mediante citometría supone una herramienta muy útil a la hora de medir cambios en la concentración de iones en células definidas fenotípicamente.
- MAGNESIO
El Magnesio es un cofactor enzimático importante en los procesos biológicos, incluida la producción de energía, la fosforilación oxidativa y el transporte de iones. Su déficit puede aumentar el riesgo cardiovascular y la resistencia a la insulina. Fox et al., (2007), utilizaron una sonda fluorescente, Magnesium Green, para calcular el magnesio intracelular en las plaquetas.2
- ZINC
El Zinc es un oligoelemento necesario que utilizan más de 300 proteínas implicadas en procesos como el metabolismo de los ácidos nucleicos, la replicación celular o la reparación de tejidos. La deficiencia de Zn puede conducir a una variedad de problemas que van desde el deterioro de la inmunidad hasta el desarrollo neuronal atrofiado y el cáncer. Existe una sonda permeable a las células que permite la medida del Zn mediante citometría de flujo. Zinpyr-1 tiene una excitación máxima de 515 nm y una emisión máxima de 525 nm, lo que lo hace adecuado para aplicaciones de citometría de flujo. Malavolta et al., (2006) utilizaron esta sonda para estimar la disponibilidad de zinc en las células T CD4 y CD8.3
CONCLUSIÓN
Estos ensayos demuestran el poder de la citometría de flujo como herramienta para medir cambios en la concentración de iones intracelulares. Y, por tanto, la posibilidad de evaluar diferentes procesos de señalización celular en poblaciones definidas fenotípicamente.
En la próxima newsletter nos centraremos en análisis de las especies reactivas de oxígeno (ROS) y el potencial de membrana, como otros procesos intracelulares que somos capaces de monitorizar mediante citometría de flujo.
AUTOR
Ángela Marquina, MSc.
Bioquímica
Técnico Titulado Superior del Servicio de Citometría de Flujo
Hospital Nacional de Parapléjicos
Toledo, España.
REFERENCIAS
- https://bcf.technion.ac.il/portfolio/calcium-flux/.
- Chester H Fox et al., (2007). A method for measuring intracellular free magnesium concentration in platelets using flow cytometry. Magnesium Research. 2007;20(3):200-207. doi:10.1684/mrh.2007.0105.
- Malavolta, M. et al., (2006). Single and three-color flow cytometry assay for intracellular zinc ion availability in human lymphocytes with Zinpyr-1 and double immunofluorescence: relationship with metallothioneins. Cytometry. Part A : the journal of the International Society for Analytical Cytology, 69(10), 1043–1053. doi: 10.1002/cyto.a.20335.