2.1. STED o Stimulated Emission Depletion Microscopy.
Stefan Hell desarrolló esta técnica utilizando dos rayos láser para iluminar la muestra: uno en configuración confocal que ilumina una región limitada por difracción, y otro que desactiva las moléculas en la orilla de esta zona por emisión estimulada. El segundo láser logra lo anterior gracias a que tiene un modo transversal en forma de “donut”, el cual rodea la iluminación del primer láser.
Con esto se logra que el área que produce la fluorescencia realmente sea de solo unos cuantos nanómetros. Midiendo la intensidad de la fluorescencia emitida por las moléculas que se encuentran solo en la región central del primer haz, se forma una imagen con una resolución hasta diez veces mayor a la obtenida con un microscopio confocal convencional.

2.2. PALM/ STORM
Por otro lado y llegando a los mismos resultados de resolución a nivel nanométrico se desarrollaron las investigaciones de William Moerner y Eric Betzig. Las cuales se basan en la localización de moléculas individuales.
Cuando la distancia entre moléculas fluorescentes es mayor al límite de difracción, es posible obtener un perfil de intensidad del patrón de Airy formado en el microscopio, cuyo análisis permite encontrar el centro del disco (esto es, la posición real de la molécula), con una exactitud que depende sobre todo del número de fotones que se detectan. (Ver Newsletter anterior).
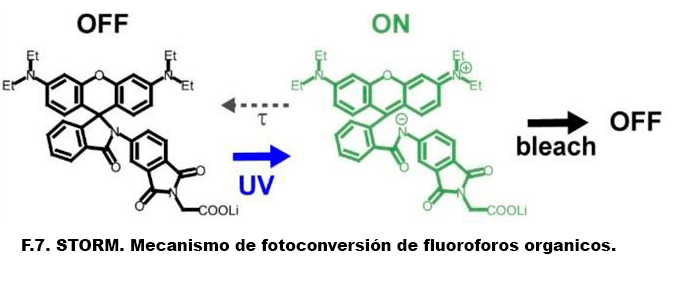
Sin embargo, en una muestra real, la densidad de las moléculas fluorescentes debe ser alta para poder observar las estructuras, y la distancia promedio entre emisores es mucho menor al límite de difracción. Pues bien, para poder observar a los emisores individualmente, es necesario que solo una molécula por cada región espacial del orden de un disco de Airy este emitiendo luz y las demás estén apagadas o sin emitir luz. Esto se ha conseguido utilizando moléculas que pueden ser activadas con pulsos de luz de manera selectiva y estudiadas transitoriamente hasta que son destruidas o apagadas por otro haz de luz diferente. Esta activación se lleva a cabo mediante transformaciones foto-inducidas que llevan a los marcadores moleculares de una forma no-fluorescente a una forma fluorescente cuya emisión es detectada.
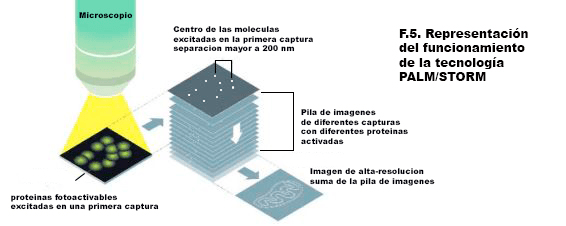
Una vez marcada la posición de cada emisor (por tanto de cada molécula), se reconstruye una imagen en forma de un mapa de localización que tiene una resolución diez veces mejor a la obtenida por técnicas convencionales. Esta metodología se ha seguido ido desarrollando en los últimos años y han dado lugar a la invención de una gran familia de técnicas que siguen los mismos principios, y son denominadas colectivamente como microscopía de super-resolución. El rápido avance que se ha dado en esta área ha ido a la par de una gran cantidad de estudios que han arrojado información sin precedentes sobre las estructuras de las células y su conformación, así como las propiedades, funciones e interacciones de proteínas in vivo.
En las técnicas de PALM se utiliza proteínas fluorescentes parecidas a la GFP fotoactivable que muestran un fotocromismo controlable, llamadas proteínas fluorescentes fotointerructores. Sin embargo, el desarrollo de STORM, que comparte el mismo principio fundamental, originalmente utilizó fluoróforos orgánicos reversibles fotoconmutables, como las cianinas que bajo ciertas condiciones de buffer, pueden transferirse entre un estado encendido o brillante y un estado apagado u oscuro. Para esto se utiliza luz roja y verde, además de fluoróforos activadores cercanos.