La cromatografía líquida de nano-flujo ha sido el pilar en la investigación de proteomas durante más de 20 años, principalmente porque los flujos bajos mejoran la ionización de péptidos por electrospray (ESI) por espectrometría de masas (MS) y, por lo tanto, la sensibilidad. Sin embargo, esto tiene como inconveniente el desafío de fabricar columnas reproducibles y duraderas, mantener el electrospray estable durante períodos de tiempo prolongados, realizar cargas cromatográficas rápidas, tener saturación en la espectrometría y, a menudo, largos tiempos improductivos para la transferencia de muestras a velocidades de flujo bajos. Estos factores pueden limitar la reproducibilidad de la identificación y cuantificación de péptidos, así como la exhaustividad, solidez y rendimiento del análisis de proteomas, especialmente cuando se analizan muestras de alta complejidad o amplio rango dinámico de concentraciones de proteínas como ocurre en tejidos y fluidos corporales.
Particularmente para ensayos de espectrometría de masas cuantitativos como SRM (Selected reaction monitoring) o PRM (parallel reaction monitoring), donde el espectrómetro de masas se enfoca en una pequeña cantidad de analitos para maximizar la sensibilidad y la precisión cuantitativa, columnas de HPLC analíticas estándar (2,1 mm de diámetro interno, DI) se utilizan con frecuencia para abordar los desafíos antes mencionados. También para los análisis de adquisición independiente de datos (DIA), métodos que tienen como objetivo detectar los péptidos presentes en una muestra de forma sistemática, el campo está adoptando cada vez más columnas de diámetro interno de 300 µm como compromiso entre sensibilidad y robustez.
Como la sensibilidad de los espectrómetros de masas ha mejorado enormemente a lo largo de los años como resultado de, por ejemplo, una ionización más eficiente o una mejor transferencia y detección de iones, nuevos avances en estrategias no dirigidas o dependientes de datos (DDA) pueden llevarse a cabo mejorando la separación peptídica.
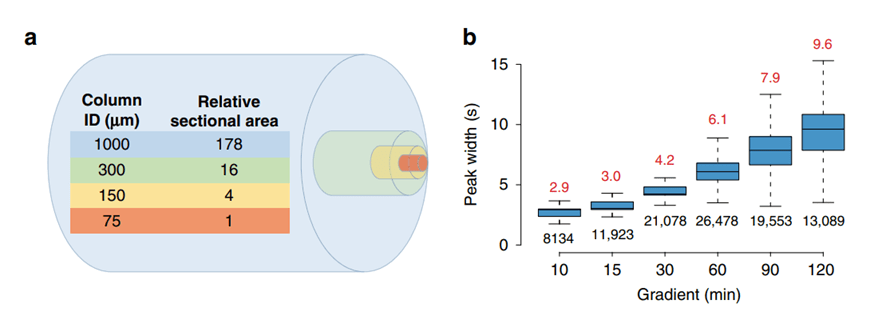
Figura 1. Características de rendimiento cualitativo del sistema LC – MS / MS de micro-flujo.
El área de la sección transversal de una columna LC de flujo micro de 1 mm de DI es 178 veces más grande que el de una columna LC de nano flujo de 75 µm de DI que se utiliza normalmente en la investigación de proteomas y el incremento en el flujo se incrementa de la misma manera (Fig. 1a). Mientras que un diámetro de columna más amplio mejora la eficiencia de la separación al eliminar la sobrecarga de la columna, el mayor caudal necesario para una columna de 1 mm de DI en comparación con una columna LC de nano flujo, diluye masivamente el analito, concentración que debería conducir a una fuerte pérdida de la eficiencia de ionización en el electrospray (ESI) y, como resultado, pérdida en la sensibilidad. Pero se ha encontrado que esto se puede compensar parcialmente por los picos tan estrechos que proporciona la tasa de flujo más alta produciendo la concentración de péptido (Fig. 1b).
Por ello, el uso en auge del flujo micro, usando una columna de 1 × 150 mm muestra una excelente reproducibilidad del tiempo de retención cromatográfica (<0.3% coeficiente de variación, CV) y cuantificación de proteínas (<7.5% CV) usando datos de más de 2000 muestras de líneas celulares, tejidos y fluidos corporales humanos. El análisis profundo de proteomas identifica más de 9.000 proteínas y más de 120.000 péptidos en 16 h, y la multiplexación de muestras marcadas utilizando la espectrometría en tándem aumenta el rendimiento a 11 proteomas en 16 h. El sistema identifica más de 30.000 fosfopéptidos en 12 horas y los experimentos de interacción proteína-proteína o proteína-fármaco pueden analizarse en 20 minutos por muestra. La misma columna se puede utilizar para analizar más de 7500 muestras sin una aparente pérdida de rendimiento.
Estos datos demuestran que la LC – MS / MS de microflujo es adecuada para una amplia gama de aplicaciones proteómicas.
Artículo:
https://www.nature.com/articles/s41467-019-13973-x
Normal 0 21 false false false ES X-NONE X-NONE
AUTOR
Alba González Arandilla, MSc.
Química
Técnico Titulado Superior del Servicio de Proteómica
Hospital Nacional de Parapléjicos
Toledo, España.