La cantidad de células presentes en una muestra es un factor limitante en citometría de flujo. Muestras muy preciadas como las procedentes de líquido cefalorraquídeo o de médula ósea tras una quimioterapia, cuentan con un número de células muy escaso. Por tanto, resulta casi imposible dividir dichas muestras para analizar el mayor número de posible de parámetros y obtener la máxima información de estas.
La citometría multiparamétrica de “high throughput” nos permite analizar en una sola muestra la composición celular, distinguir subpoblaciones celulares heterogéneas así como reconocer una gran cantidad de proteínas (superficiales e intracelulares), incluso en su estado fosforilado. Todos estos parámetros se analizan en paralelo en una misma muestra.
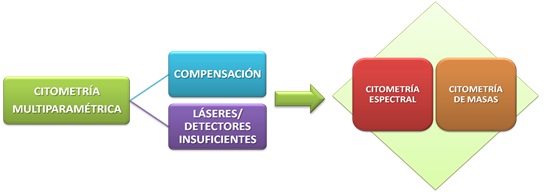
Sin embargo, existen una serie de desafíos técnicos que surgen a los usuarios de este tipo de citometría. El primero, no tener un citómetro con láseres y detectores suficientes, ya que los citómetros convencionales constan de hasta 4 láseres y son capaces de detectar hasta 13 colores. El segundo, que la necesidad de compensar fluorescencias sea mayor debido al solapamiento de los espectros de emisión de los fluoróforos.
La necesidad de compensar viene dada fundamentalmente por el espectro de emisión del fluorocromo, ya que el rango de longitud de onda de éste puede solaparse con otro provocando que el equipo recoja fluorescencia en los detectores secundarios. Por esta razón, es muy importante compensar mediante el uso de controles de compensación que contienen cada uno de los anticuerpos por separado, y nos van a ayudar a eliminar la contribución de cada fluorocromo en el resto de detectores (ver Figura 4).
Hoy en día los citómetros más actuales incluyen librerías en las que permiten guardar los espectros de cada fluorocromos una vez han sido analizados por el equipo, evitando así tener que preparar controles con cada experimento y facilitando la compensación. Sin embargo, en los experimentos multiparamétricos sigue siendo complicado compensar debido a que la poca variedad de fluoróforos y detectores hace que solapen más unos con otros.
Estas limitaciones de los citómetros convencionales han contribuido al desarrollo de nuevas formas de citometría que intentan resolver esos problemas: la citometría espectral, que te permite leer el espectro de cada fluorocromo de forma única (como si fuese una firma única que se distingue del resto), y la citometría de masas, que te permite analizar una elevada cantidad de parámetros evitando los problemas de los espectros de emisión al emplear anticuerpos unidos a iones metálicos.
CITOMETRÍA ESPECTRAL
Mientras que la citometría convencional utiliza espejos y filtros para seleccionar un rango de longitud de onda especifico para detectar la señal de diferentes fluorocromos en los tubos fotomultiplicadores (PMTs); la citometría espectral, emplea un sistema óptico dispersivo como los primas o red de difracción (ver Figura 1) para dispersar la luz, que a continuación se recoge a través de una variedad de detectores array. Estos pueden ser fotodiodos de avalancha (APDs) o PMTs con múltiples canales y permiten que se mida el espectro completo de cada partícula creando una especie de “huella digital” de las longitudes de onda que se emiten.
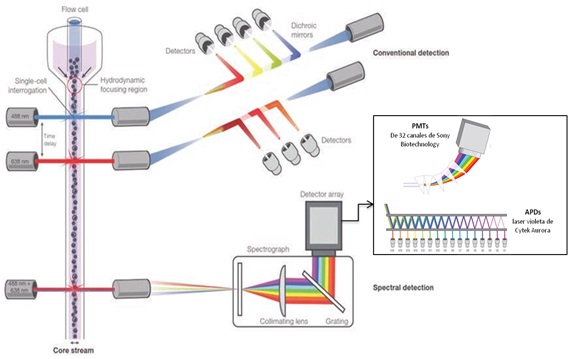
Figura 1. Esquema comparativo entre la citometría convencional y espectral. A la derecha de la imagen observamos los tipos de detectores empleados en citometría espectral, PMTs (ej.: 32 canales del citómetro de Sony Biotecnology) y APDs (ej.: 16 APDs del laser violeta de Cytek Aurora).

Figura 2. Comparación entre la detección convencional de FITC frente a la detección espectral. A) En citometría convencional solo se recoge de los 515 a 545 nm (filtro 530/30 BP). Sin embargo, B) en citometría espectral se recoge la emisión completa, desde los 490 a los 650 nm, en los múltiples detectores.
Como hemos comentado con anterioridad, los citómetros de flujo espectral capturan el espectro de emisión de la molécula fluorescente, obteniendo más datos de fluorescencia. Esto permite que, las pequeñas diferencias entre moléculas fluorescentes muy similares, que nunca podrían usarse juntas en citometría convencional, como la aloficocianina (APC) y el Alexa Fluor 647, se puedan diferenciar fácilmente en un citómetro espectral tanto de 3 como de 5 láseres. La discriminación entre dichos fluoróforos se basa en las diferencias en sus espectros generales (como se ve en los círculos rojos en la Figura 3) en lugar de en la detección en un canal individual.
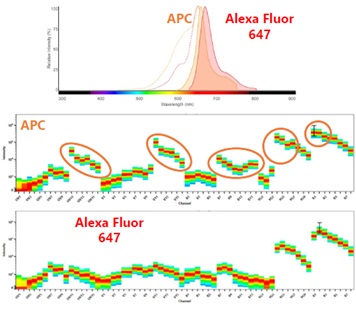
Figura 3. Comparación de huellas espectrales entre dos fluorocromos compatibles. Aunque APC y Alexa Fluor 647 se detectan principalmente en rojo, son compatibles cuando se analizan en el citómetro de flujo espectral de 5 láseres Aurora Cytek. Esto es debido a que se observan patrones distintos en los detectores de los láseres ultravioleta, violeta y azul, que permiten discriminar ambas moléculas fácilmente.
En el análisis de citometría de flujo espectral no se compensan las muestras, sino que se lleva a cabo lo que se conoce como spectral unmixing o deconvolución espectral (ver Figura 4). Se basa en la identificación de las huellas espectrales individuales de los fluoróforos en los experimentos multicolor. De esta manera se calcula, mediante algoritmos matemáticos, la contribución del espectro de cada fluoróforo al total de la señal de emisión recogida de cada célula presente en nuestra muestra.
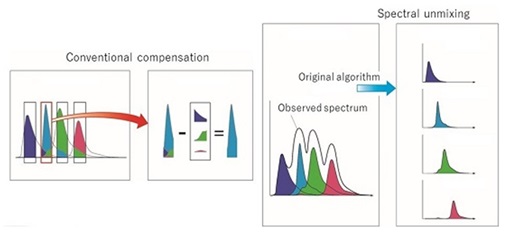
Figura 4. Comparación entre la compensación convencional y la deconvolución espectral.
Dado que el número de fluorocromos disponibles para los investigadores es cada vez mayor (ya se están desarrollando fluoróforos en rojo lejano), el spectral unmixing supone una gran ventaja respecto a la compensación al eliminar la subjetividad y la complejidad que se encuentran asociadas a este método convencional.
CITOMETRÍA DE MASAS (CyTOF)
La citometría de masas o CyTOF (Fluidigm), es una adaptación de un Espectrómetro de Masas de Plasma Acoplado Inductivamente (ICP-MS) al análisis unicelular. En esta variante de la citometría de flujo, las células se tiñen con anticuerpos que están marcados con iones de metales pesados (lantánidos principalmente) en lugar de fluorocromos. Las células teñidas se nebulizan en gotas con una única célula y se introducen en el plasma, ionizándose todos los componentes celulares (C, N, O). La nube de iones cargados resultante se transfiere inmediatamente al cuadrupolo, el cual actúa como filtro permitiendo solo el paso de los iones más pesados con los que han sido marcadas las células. La detección y cuantificación de las células individuales se lleva a cabo mediante un espectrómetro de masas de tiempo de vuelo (TOF). Finalmente, los datos de resultantes se registran en formato de archivo FCS para que puedan visualizarse con cualquier software de citometría de flujo convencional (Figura 7).
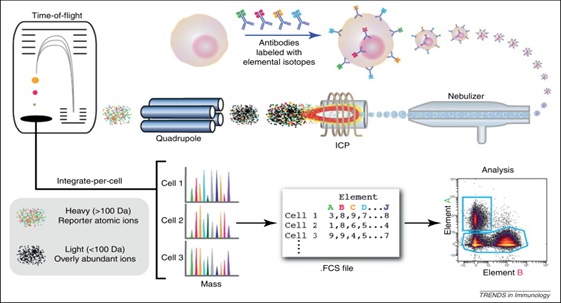
Figura 5. Esquema de funcionamiento y componentes de un citómetro de masas.
El empleo de anticuerpos unidos a lantánidos en lugar de fluoróforos, soluciona el problema de la compensación que nos surge al realizar estudios multiparamétricos permitiéndonos distinguir fácilmente subpoblaciones celulares heterogéneas y complejas (como puede ser el sistema inmune), combinando hasta 35 colores de manera simultánea. Sin embargo, se trata de una tecnología mucho más cara y compleja que la citometría espectral.
CONCLUSIONES
La citometría multiparamétrica de “high throughput”, que permite estudiar más de 40 marcadores fluorescentes en una sola muestra, supone el desarrollo de tecnologías más potentes y avanzadas que faciliten la obtención de resultados precisos y específicos, eliminando por ejemplo, el problema de la compensación. Los resultados obtenidos con este tipo de citometría multiparamétrica son enormes y de gran complejidad, lo que conlleva un análisis de datos más complejo (“High-Dimensional Analysis”) que será objeto de futuras newsletters.
Más información:
S.C. Bendall, G.P. Nolan, M. Roederer, P.K. Chattopadhyay. A deep profiler’s guide to Cytometry. Trends Immunol., 33 (2012), pp. 323-332.