Las vesículas extracelulares (EVs) son pequeñas partículas rodeadas por una bicapa lipídica que son secretadas por todo tipo de células, y que constituyen un mecanismo de comunicación intercelular muy importante. Todas las células que se encuentran creciendo activamente o en una situación de estrés, van a secretar EVs al medio externo.
A lo largo de los años las EVs han recibido multitud de nombres, pero actualmente se recomienda la división en exosomas y microvesículas o ectosomas, atendiendo a su rango de tamaños y a su ruta de biogénesis.
Los exosomas son vesículas de entre 40-100 nm de diámetro secretadas a partir de cuerpos multi-vesiculares (MVB: “Multi-Vesicular Bodies”) generados en el interior celular a partir de endosomas, mientras que las microvesículas o ectosomas tienen tamaños entre 100 nm y 1 µm de diámetro y se producen por evaginación directa de la membrana plasmática.
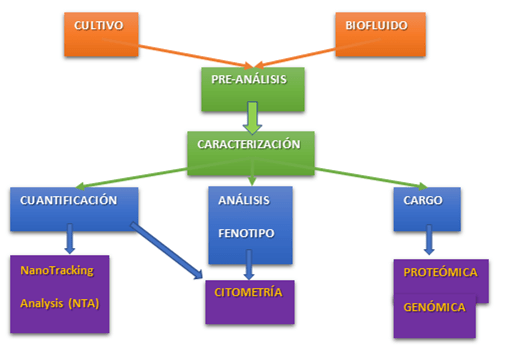
Ambos tipos de EVs comparten distintas características, lo que a veces hace difícil su distinción o purificación por separado. Lo que sí está claro es que la composición de las EVs no es aleatoria y va a reflejar el estado de la célula que las produce, existiendo diversas moléculas y grupos de moléculas que se encuentran enriquecidas en las mismas. El contenido de las EVs se denomina CARGO y va a ser el responsable de los efectos que tengan esas EVs sobre otras células o tejidos, de ahí que una de las principales finalidades del estudio de las EVs sea el conocimiento de su cargo específico.
Por tanto, el estudio de las EVs va a incluir tanto la caracterización de las mismas en cuanto a nº de partículas, fenotipo, presencia en condiciones normales o patológicas, etc, así como la caracterización de su cargo específico mediante identificación de RNAs y/o estudios proteómicos.
Con el fin de realizar estudios lo más estandarizados posible y con unos controles de calidad adecuados que aseguren una correcta identificación de EVs, la Sociedad Internacional de Vesículas Extracelulares (ISEV) ha elaborado una guía con la información mínima que debe contener un estudio de EVs (MISEV). Esta guía incluye diversas cuestiones a tener en cuenta: desde cuáles son los factores preanalíticos del estudio, hasta las recomendaciones para llevar a cabo ensayos funcionales. Podéis encontrar el artículo en el siguiente enlace:
Minimal information for studies of extracellular vesicles 2018 (MISEV2018)
Fruto del trabajo conjunto de la ISEV y de la Sociedad Internacional para el Avance de la Citometría (ISAC), se ha publicado una guía más específica para los estudios que utilicen la Citometría de Flujo (CITF) como el método de elección para la caracterización fenotípica de EVs y su identificación y uso como biomarcadores:
Vamos a ver a continuación algunas cuestiones a tener en cuenta en un estudio de este tipo, incluidas en esta guía.
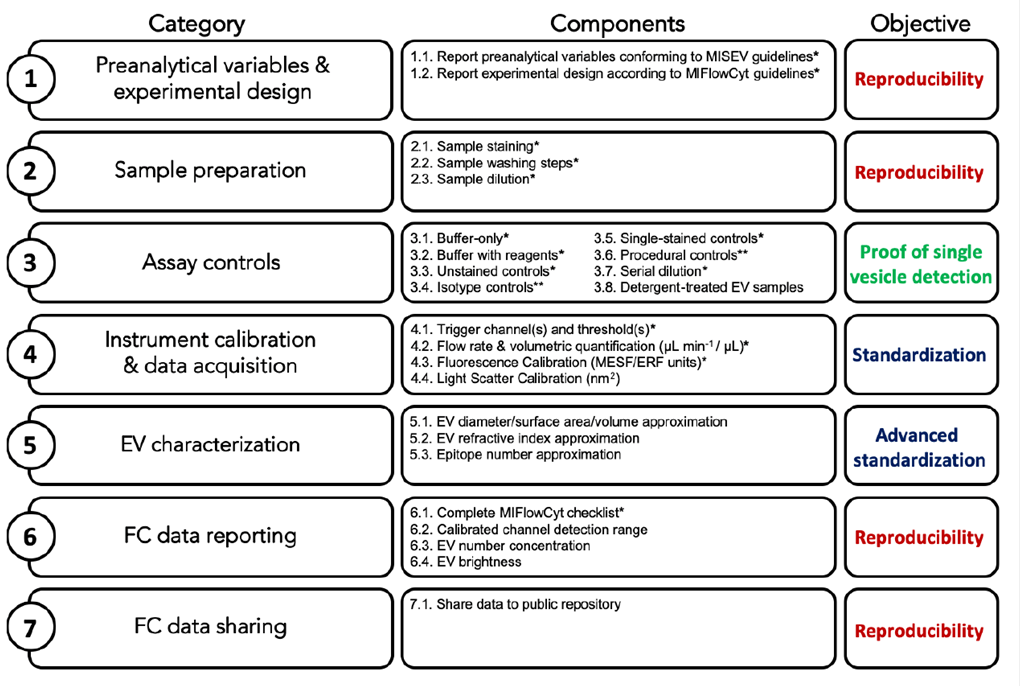
Fig. 2. Esquema de la información mínima que debe tener un estudio de EVs por citometría.
VARIABLES PREANALÍTICAS
Para trabajar con EVs va a ser necesario utilizar diversas técnicas que nos permitan confirmar que se ha realizado una correcta separación de las mismas a partir de una muestra biológica, así como identificar las moléculas contenidas en las mismas.
La elección de las técnicas más adecuadas para el enriquecimiento y caracterización de las EVs va a venir definida por el objetivo final de nuestra preparación, así como por la pregunta científica. Así, no es lo mismo querer determinar el cargo de las EVs (ya sea procedentes de un biofluido o de un medio condicionado), que identificar un determinado tipo de EV en un biofluido para usarlo como un biomarcador, ni tampoco caracterizar las EVs procedentes de un medio condicionado. Cada uno de los objetivos determinará tanto las variables preanalíticas a tener en cuenta como el método de enriquecimiento, purificación, caracterización y determinación del cargo.
Por ejemplo, en el caso de estudiar EVs procedentes de un medio condicionado, hay que tener en cuenta desde las placas o contenedores en que se cultivan dichas células, hasta la confluencia, tiempo de pase, procedimientos de aislamiento, nº de células muertas presentes en el cultivo, y algo muy importante: la composición del medio de cultivo y la utilización de suero LIBRE de EVs. Esto es así porque el suero fetal bovino es una fuente muy importante de EVs. Este tipo de suero se puede adquirir en una casa comercial específica, o podemos realizar un procedimiento para eliminar esas EVs mediante ultracentrifugación. En los siguientes enlaces se puede encontrar un protocolo de obtención de FBS libre de EVs, así como un ejemplo de protocolo de aislamiento por ultracentrifugación + gradiente:
Obtención de FBS libre de exosomas mediante ultracentrifugación
Protocolo para aislamiento de EVs de medio condicionado
En el caso de la obtención de EVs a partir de biofluidos, como por ejemplo de plasma, es muy importante estandarizar los métodos de obtención y transporte de la muestra, incluyendo el tipo de aguja utilizada para la extracción, el tipo de tubo usado para la recolección siendo el recomendado el de citrato sódico como anticoagulante, descartar los 2-3 primeros ml de sangre extraída, omitir muestras hemolizadas, y procesar las muestras lo antes posible, ya que los fluidos no procesados son inestables y pueden seguir produciéndose EVs por parte de las células presentes en la muestra. Además, hay que tener en cuenta que la utilización de métodos de ultracentrifugación de plasma sin otras técnicas adicionales (como la utilización de gradientes adicionales) puede co-aislar gotas lipídicas que contengan quilomicrones y LDL que puedan darnos datos erróneos en la cuantificación de EVs.
PREPARACIÓN DE LAS MUESTRAS
Una vez obtenidas muestras enriquecidas en EVs por cualquiera de los distintos métodos posibles (ultracentrifugación, filtración, cromatografía de exclusión molecular, etc), para caracterizarlas por CITF hay tres variables fundamentales:
- Tinción de las muestras: puesto que las EVs son muy pequeñas, el nº de moléculas de anticuerpo que van a incorporar a su superficie va a ser muy pequeño con lo que vamos a necesitar anticuerpos y reactivos de calidad, con una conjugación de fluorocromo eficiente y de alto brillo.
- Lavados: necesarios para eliminar el ruido del reactivo. Al aumentar el nº de lavados para eliminar el reactivo de tinción, pueden perderse EVs y alterar las características de las muestras en cuanto a composición de las EVs.
- Diluciones: para una adecuada detección de las EVs por CITF va a ser necesario llegar a una concentración adecuada que nos permita detectar partículas individuales.
CONTROLES
Puesto que las EVs están en el límite de detección de los equipos, es muy importante establecer una serie de controles que nos permitan asegurarnos de que estamos identificando correctamente las EVs y de manera individual.
- CONTROL SÓLO TAMPÓN: necesario para comprender cuáles son las señales de fondo producidas por el medio en el que se encuentran diluidas las EVsà adquisición del medio de dilución de las EVs
- CONTROL TAMPÓN + REACTIVOS: Los reactivos no unidos pueden agregar y ser detectados como eventos positivos à adquirir muestra que contenga el medio de dilución de las EVs y los reactivos a la misma concentración utilizada para teñir las muestras. Deben analizarse con la misma dilución y los mismos settings experimentales que la muestra problema.
- CONTROL SIN MARCAR: La finalidad es determinar si la muestra puede presentar autofluorescencia en los mismos canales en los que vamos a buscar las moléculas de interés à deben tener la misma concentración de EVs que la muestra teñida y ser analizadas con la misma dilución y los mismos settings experimentales que la muestra teñida.
- CONTROLES DE ISOTIPO: La finalidad de estos controles es analizar la posible unión inespecífica de los anticuerpos utilizados en la muestraà muestras teñidas con anticuerpos del mismo isotipo y conjugados con los mismos fluorocromos que los anticuerpos con los que teñimos la muestra (a la misma concentración y con los mismos settings experimentales).
- CONTROLES “SINGLE-STAINED”: Controles para identificar la contribución de cada fluorocromo a cada detector utilizado à muestras teñidas sólo con un anticuerpo, también usados como controles de compensación. En las mismas condiciones de la muestra teñida.
- CONTROLES DE PROCEDIMIENTO: Algunos protocolos de tinción requieren procesamientos posteriores a la tinción à hay que realizar todos los controles que incluyan todas las variables del procedimiento.
- DILUCIONES SERIADAS: Estos controles de diferentes diluciones van a servir para asegurarse de que estamos analizando partículas únicas à Hay que hacer diluciones seriadas y representar el factor de dilución contra el total del nº de eventos adquiridos y la intensidad de fluorescencia y/o la dispersión de luz para demostrar que maximizamos la detección de EVs individuales. Si observamos que disminuye el nº de eventos con la dilución pero no encontramos disminución en la intensidad de fluorescencia, estamos detectando partículas individuales.
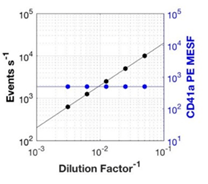
Fig.3. Representación del nº de eventos y de la intensidad media de fluorescencia frente al factor de dilución
- CONTROL CON DETERGENTE: Como las EVs están rodeadas por una bicapa lipídica, el uso de detergentes puede ayudarnos a comprobar esta naturaleza y que la señal que observamos no se debe a agregados de anticuerpoà añadir detergente (ej. Tritón X-100, Tween-20) a las muestras teñidas y analizarlas como las muestras problema. Si desaparece el marcaje, nos dará la prueba de que la tinción que observamos en la muestra es realmente debido a las EVs.
CONCLUSIONES FINALES
Al estar en el límite de detección de los equipos existentes en el mercado, los estudios con EVs requieren de una serie de controles adicionales que no se requieren en estudios con células completas.
Las guías sobre cuál es la información mínima que se debe recoger en los estudios con EVs, nos aportan una ayuda inestimable para el diseño experimental y la recolección de resultados.
Más información:
https://www.youtube.com/channel/UC9Aq1Ha2vvP-sq4qZ6xQBMA
2 comentarios sobre “VESÍCULAS EXTRACELULARES”