La manera de obtener imágenes tridimensionales de la médula a buena resolución y en poco tiempo.
En la newsletter de hoy el SMAI quiere presentaros la microscopía de fluorescencia de lámina de luz o LSFM acrónimo de la técnica en inglés (Light sheet fluorescent microscopy). Esta es una técnica de microscopía de fluorescencia con una buena resolución óptica en XY y con muy buena resolución en Z además de ser de alta velocidad, lo que permite ser la mejor técnica para seccionamiento óptico (reconstrucciones 3D).
LSFM es un microscopio de fluorescenca, pero con una diferencia muy importante con la microscopía de fluorescencia convencional y la confocal, esta diferencia, es la forma en la que se ilumina la muestra. Mientras que en los microscopios de fluorescencia convencional (epifluorescencia) la iluminación llega atreves del objetivo para excita la muestra y la luz emitida por dicha muestra es recogida de nuevo por el objetivo, en la LSFM la muestra se ilumina perpendicularmente a la observación de la muestra. Esta iluminación perpendicular a la observación permite iluminar solo una porción muy delgada (generalmente de unos cientos de nanómetros a unos pocos micrómetros) de la muestra (ver figura 1).
Para la iluminación, se utiliza una lámina de luz láser, es decir, un rayo láser que se enfoca solo en una dirección creando un plano de luz (por ejemplo, usando una lente cilíndrica). Como solo se ilumina la sección realmente observada, este método reduce el fotodaño y el estrés producido a muestras vivas. Además, la buena capacidad de seccionamiento óptico reduce la señal de fondo y, por lo tanto, crea imágenes con mayor contraste, comparable a la microscopía confocal. Debido a que LSFM escanea muestras usando un plano de luz en lugar de un punto, puede adquirir imágenes a velocidades de 100 a 1000 veces más rápidas que las que ofrecen los métodos de microscopía confocal que escanean punto a punto toda la muestra.
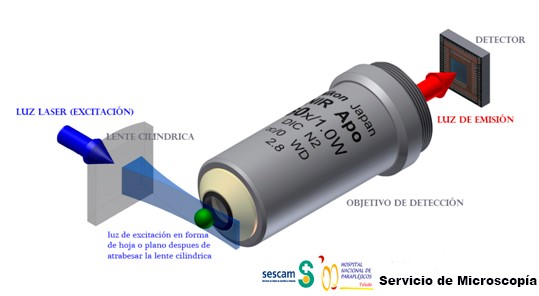
En la actualidad varias casas comerciales venden microscopios para hacer LSFM y para ello crean unas cámaras donde colocar la muestra a observar. Esas cámaras están compuestas por juegos de dobles objetivos, uno para el sistema de iluminación y otro objetivo para la observación o detección. El objetivo para la observación es un objetivo convencional con sus lentes correspondientes y el objetivo de iluminación es perpendicular al anterior y contiene una lente cilíndrica que crea el plano u hoja de luz que ilumina la muestra (ver figura 2 donde en el primer cuadrante “A” se muestra un sistema normal de epifluorescencia y en el resto de cuadrantes se muestran diferentes configuraciones de la cámara de observación e iluminación para LSFM).

Para entender bien esta técnica debemos compararla con Microscopia confocal y con microscopia convencional de WF (campo amplio, microscopio de epifluorescencia o los VTL que tenemos en el servicio). La microcroscopia de WF es mucho más rápida que la microscopía confocal, puesto que se recoge todo el campo observado con un detector (CCD) y el tiempo de captura solo depende del tiempo de exposición. La microscopía confocal es mucho más lenta puesto que la muestra es escaneada punto a punto por la luz laser y la imagen ha de formarse después del escaneo. Sin embargo la resolución en Z es mucho mejor en la microscopía confoca, permitiéndonos hacer reconstrucciones 3D, gracias al pinhole de la microscopía confocal solo detectamos la emisión de la muestra de un plano focal muy delgado, quitando de la imagen la zona desenfocada por encima y por debajo del plano focal. Por tanto, mientras que con microscopia de campo amplio (WF) es más rápida, la imagen no nos permite hacer reconstrucciones 3D ni ver en detalle los planos en Z, puesto que nos muestra todo lo excitado en profundidad, incluso aquello que está desenfocado. (ver figura 3, comparación microscopia WF y microscopía confocal).

Pues bien, la técnica de LSFM combina la velocidad de WF con la resolución en Z de la microscopia confocal, pero además a la hora de excitar la muestra y gracias a la iluminación en forma de plano u hoja de luz muy delgada, solo es excitado el Z capturado, ahorrándonos el floto daño que se produce tanto en la microscopia WF como en la confocal.
En la siguiente imagen comparamos tanto la iluminación como la detección en la microscopía confocal con la LSFM.
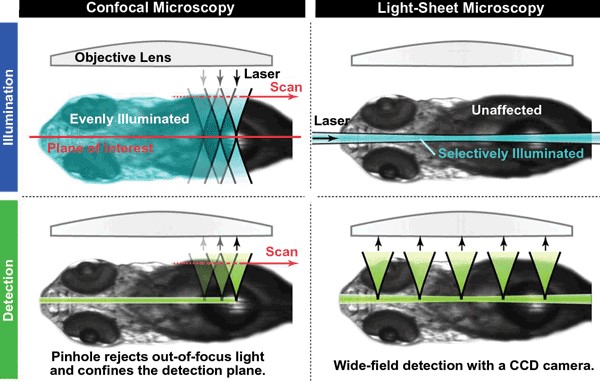
En la parte izquierda vemos como funciona la iluminación (arriba) y la detección (abajo) del microscopio confocal. Vemos que se ilumina gran parte de la muestra produciéndose un escaneo punto a punto y se detecta un plano de interés muy delgado pero punto a punto. En la parte derecha (LSFM) vemos que la muestra solo es iluminada en un plano delgado y se detecta a la vez todo el plano iluminado. Moviendo esa iluminación de abajo arriba podemos hacer una reconstrucción 3D de toda la muestra en un tiempo relativamente rápido y sin producir un daño importante por la luz.
Con todo esto, esta técnica es muy útil para trabajar en biología celular e histológica. Principalmente se ha utilizado para el estudio de desarrollo embrionario en las primeras fases, haciendo videos de reconstrucciones 3D de los procesos del desarrollo con enorme resolución. Aquí tenéis un video muy corto de cómo quedaría en las primeras fases de desarrollo embrionario.
Pero, ¿cómo puede ser útil en las investigaciones que se hacen en el HNP?, Pues bien, esta técnica también se ha utilizado para el estudio de tejidos y órganos e incluso pequeños animales, pero para ello es necesario aclarar el tejido. En Neurociencia se ha utilizado en medula espinal sanas y lesionadas, pero siempre es necesario un proceso de aclarado con Tetrafurano (THF) del tejido. A continuación tenéis el enlace a dos artículos de los mejores que he visto sobre el aclarado de medula espinal y posterior utilización de LSFM.
-3D Imaging of Axons in Transparent Spinal Cords from Rodents and Nonhuman Primates.
NOTA: Si alguien está interesado en el material suplementario del segundo artículo que se ponga en contacto con José Angel Rodriguez.
Por último podéis reproducir esta webinar de casi una hora donde explican la técnica y a mitad de la presentación hablan del aclaramiento de tejido.
https://www.zeiss.com/microscopy/int/cmp/lsc/20/light-sheet-microscopy/light-sheet-7-webinar.html
Creemos que esta técnica puede ser muy útil para algunos de los grupos de la Udi del HNP y hemos investigado si sería posible acoplar este sistema de iluminación a alguno de los microscopios que tenemos, en principio parece que no es posible, pero en Ciudad Real compraron un equipo de LSFM el año pasado y podrían darnos servicio si fueses necesario, y quién sabe si en un futuro puede ser nuestra nueva adquisición.